

西方城市和社区环境对糖尿病的影响路径研究评述
(1. 天津大学建筑学院, 天津 300072
2. 中国医学科学院医药生物技术研究所, 北京 100050)
摘要: 2019年我国糖尿病患者数量达1. 16亿, 位居世界第一。糖尿病对国民健康和社会经济发展产生了巨大威胁, 迫切需要多学科的协同研究。基于此, 本文系统梳理了近年来西方学界关于城市和社区环境对糖尿病影响的研究, 归纳出城市层面的城市化水平、城市形态、族裔文化与居住隔离、通勤方式等因素驱动的影响路径, 和社区层面的社区食物环境、社区体力活动空间、社区及周边绿色空间、社区社会环境和噪音等因素驱动的影响路径, 并评述以上环境因素主要通过影响个体的生活方式、体力活动、饮食行为、心理压力、睡眠等行为和心理因素, 进而对糖尿病患病风险产生间接影响。本文将为正在起步的我国城市建成环境对糖尿病影响的研究提供借鉴, 亦为“健康我国2030”策略提供研究支撑。
关键词: 城市环境, 社区环境, 糖尿病, 饮食行为, 体力活动
DOI: 10.48014/cgsr.20220602001
引用格式: 韩羽婷, 盛明洁, 薛司徒. 西方城市和社区环境对糖尿病的影响路径研究评述[J]. 中国地理科学评论, 2023, 1(1): 31-45.
文章类型: 综述性论文
收稿日期: 2022-06-03
接收日期: 2022-08-11
出版日期: 2023-03-28
0 引言
随着城市化进程推进,中西方居民饮食结构和体力活动方式发生了巨大改变。例如,过度消费高能量、低营养价值的食物,以及久坐不动的生活方式的普及[1,2]。上述因素是糖尿病等慢性非传染性疾病的诱发因子,对世界公共健康造成巨大威胁。糖尿病是四大慢性非传染性疾病之一,根据2019年国际糖尿病联盟发布的《第9版IDF糖尿病地图》,全球每10个人就有1人患有糖尿病。我国的糖尿病情形更为严峻。比如,2017年,我国18岁以上人群中糖尿病患病率高达11.2%①,位居世界第一;2021年,我国与糖尿病相关医疗保健支出费用约1653亿美元,位居世界第二②。2010年至今,因“糖”致贫的糖尿病患者家庭数量不断上升[3]。面对糖尿病造成的日益严峻的国民健康和社会经济负担,迫切需要采取相应措施,减缓糖尿病的流行。
环境与健康有着复杂的联系。西方研究普遍表明,在较高城市化水平下,居民在城市居住时间越长,糖尿病患病风险越高[4,5]。伴随医学地理学的诞生,“地理环境暴露-时空行为-健康”的研究框架,为理解环境与糖尿病的关联提供了新的视角[6]。地理环境暴露重点探讨特定的地理背景和群体健康效应的关联[6],城市和社区是地理环境暴露研究的重要尺度,也是西方学界的研究重点,主要包括自然环境暴露、建成环境暴露、社会人文环境暴露等多个方面[6]。
西方关于糖尿病影响因素的研究大致可分为四个阶段,分别重点关注遗传、年龄等个体因素与糖尿病的关联(约1990年代前)[7,8]、族裔文化等与糖尿病的关联(约1990年代至21世纪初)[9,10]、社区食物环境、居住隔离等与糖尿病的关联(约21世纪初至2010年)[11,12],以及城市化水平、城市形态、社区体力活动空间、社区及周边绿色空间等与糖尿病的关联(约2010年至今)[4,13,14]。随着研究视角从个体向环境的转向,西方发达国家对糖尿病的干预,从早期以医疗为主的个体干预逐渐转向以公共政策为主的环境干预,并取得了一定的成效 [15,16,17]。例如,紧凑的城市形态、较高的公共交通可达性、居住地附近较多的休闲娱乐性设施、较大的绿色空间面积等,均有助于降低糖尿病患病风险[18,19,20,21]。实践方面,2016年首尔推出“步行城市”综合计划,通过改善步行环境来增加居民的体力活动水平,进而降低糖尿病患病风险。2019年新加坡总体规划中通过提供包容性的健康环境[⑥]引导居民加强体力活动,进而降低糖尿病患病风险。我国正处于快速城市化时期,迫切需要面向人民生命健康的重大需求,解决快速城市化造成的负面健康效应。环境干预策略制定离不开系统的研究,基于此,本文梳理了西方学界关于城市和社区环境对糖尿病影响的最新研究进展,以期为我国相关研究提供线索,亦为旨在减缓糖尿病患病风险的健康城市规划策略提供支撑。
1 糖尿病及其风险因素
1.1 糖尿病及其病理机制
糖尿病是一种慢性疾病,具体表现为以高血糖为特征的代谢性疾病[22]。当机体不能有效利用胰腺产生足够的胰岛素时,就会导致血糖升高,增加个体患糖尿病的风险[22]。糖尿病常见有1型糖尿病和2型糖尿病[⑦]。1型糖尿病是由自身免疫反应引起身体防御系统攻击产生胰岛素的细胞,导致机体产生的胰岛素急剧减少;2型糖尿病主要是胰岛素抵抗受胰岛β细胞的影响,当胰岛素抵抗伴有胰岛β细胞功能障碍(β-cell dysfunction)时,释放胰岛素的细胞无法控制血糖水平,且个体的糖耐量受损(Impaired glucose tolerance)和空腹血糖受损(Impaired fasting glucose)[23](图1)。2型糖尿病的诊断标准是“空腹血糖≥7.0 mmol/L或负荷后2小时血糖≥11.1mmol/L或糖化血红蛋白≥48 mmol/mol” [24]。2型糖尿病约占所有糖尿病病例的90%,主要受个体因素及外部环境因素影响 [22]。个体因素包括遗传因素、人口学特征、社会经济地位、生活方式等因素[7,25,26],外部环境因素主要包括建成环境、自然环境、社会经济和公共健康政策等因素 [18,19,27]。大多数西方城市和社区环境对糖尿病的影响研究都关注2型糖尿病。
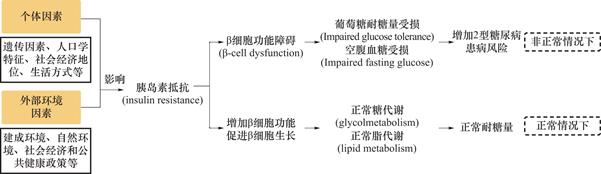
图1 个体因素、外部环境因素、胰岛素抵抗与2型糖尿病的关联
(资料来源:作者整理)
1.2 糖尿病的影响因素:从个体到环境
早期的西方研究主要关注个体因素对糖尿病的影响。例如,父母一方患有糖尿病[7]、亚裔[28]、拉丁裔群体[29]的患病率更高;饮食结构偏向高能量与低纤维[30]、长期久坐[31]、长期处于压力环境之下[32]、体重反复循环[33]、受教育程度较低[34]、收入较低[35]、职业水平较低[36]的个体患病风险更高。
1989年世界卫生组织和国际糖尿病联盟联合颁布《圣文森特宣言行动方案》(The Saint Vincents Declaration),指出要重视糖尿病风险监测、糖尿病教育、糖尿病护理等工作[37],西方研究和实践界开始逐渐从群体层面和社区层面,开展预防、干预和教育工作[16]。近年来,随着公共卫生与城市规划、地理学、社会学等学科的不断融合,糖尿病的研究视角逐渐拓展至更广泛的外部环境,城市和社区层面的建成环境特征、社会经济特征、族裔与文化特征等对糖尿病的影响逐渐引起关注[10,18,25]。大量实证研究显示,糖尿病一方面受城市发展水平、城市物质空间环境、城市社会文化环境等宏观环境因素的影响,另一方面也受个体所居住的社区建成环境、社会环境、经济业态等微观环境因素的影响[18,19,21]。据此,本文主要从城市和社区两个空间层次,系统梳理西方学界关于糖尿病影响因素的研究。
1.3 研究框架
基于Web of Science数据库平台进行文献检索,首先根据关键词、标题、摘要搜索“built environment and diabetes”“urban design and diabetes”等,得到相关文献59篇,在此基础上,根据第一轮阅读梳理的糖尿病的环境风险因素再次进行补充搜索,共获得文献71篇,其中,2010年后发表的文献中,社区环境与糖尿病关联文献占比较大,约占有24%,城市环境与糖尿病关联文献约占有8%。
通过系统梳理西方关于城市和社区环境对糖尿病患病风险影响的实证研究,本文基于“地理环境暴露-时空行为-健康”的研究范式,构建“环境风险要素-个体中介行为-糖尿病患病风险”的影响路径。本文认为,在控制了个体层面的基因、性别、年龄、收入等因素后,城市和社区层面的一系列建成环境、社会经济和文化特征将对个体糖尿病患病风险产生显著的影响。总体来说,城市层面的影响要素主要包括城市化水平、城市形态、族裔文化与居住隔离和通勤方式;社区层面的影响要素主要包括社区食物环境、社区体力活动空间、社区及周边绿色空间、社区社会环境和社区噪音。上述环境要素主要通过影响个体行为(中介变量),从而对糖尿病产生间接影响(图2)。

图2 城市和社区环境对糖尿病的影响机制
2 城市环境对糖尿病患病风险的影响路径评述
城市环境对个体糖尿病患病风险的影响,可以概括为四条路径:①城市化水平通过改变个体的生活方式(包括体力活动方式和饮食结构),进而影响糖尿病患病风险;②城市形态通过改变个体体力活动水平,进而影响糖尿病患病风险;③族裔文化与居住隔离通过影响个体的生活方式(如健康理念、健康行为和治疗偏好)和心理压力,进而影响个体适应负荷与应激激素以及体力活动水平,最终影响糖尿病患病风险;④通勤方式通过影响交通性体力活动,进而影响糖尿病患病风险。
2.1 路径一:城市化水平→生活方式→糖尿病患病风险
城市化水平是影响糖尿病患病风险的关键因素之一[38],主要通过两种途径:①伴随城市就业市场转型,脑力型就业机会增加导致久坐时间增加、体力活动减少;②伴随城市化的营养转型,促进了居民对深加工食品的消费,导致高糖低纤维的饮食结构[26],上述两种因素共同导致个体患糖尿病风险增加。但与此同时,随着城市化水平上升,社会福利增加,城市地区通过提供预防保健设施和服务,一定程度上也能降低糖尿病患病风险[39]。实证研究普遍揭示,城市化水平越高,个体糖尿病患病风险越高。
实证研究方面,Katchunga等[40]基于刚果民主共和国东部地区的669名成年人调查问卷研究显示,城市地区居民糖尿病患病风险明显高于农村地区,其潜在机制在于农村地区大多保持高体力活动水平的就业方式(如从事农业活动)。Gassasse等[4]基于207个国家数据分析城市化和2型糖尿病之间的关联,并探讨肥胖、缺乏运动和糖摄入作为中介变量的可能性,结果显示:衡量城市化水平的集聚综合指数[⑧](agglomeration index)与2型糖尿病患病风险呈显著负相关,但在完成营养转型的高收入国家中,2型糖尿病患病风险与城市化水平无关,而与不鼓励体力活动的建成环境有关。
然而,也有个别研究表明城市化水平越高,糖尿病患病风险越低。Jorgensen等[41]基于丹麦3089名格陵兰因纽特人的调查问卷研究显示,与大型城镇相比,乡村和小城镇的糖尿病和空腹血糖受损患病率最高,这很可能是由于20世纪50年代以前,格陵兰岛中大多农村产妇营养不良,增加了下一代患糖尿病的风险,揭示有必要在不同社会经济背景下研究城市化与糖尿病的关联。
2.2 路径二:城市形态→体力活动→糖尿病患病风险
蔓延的城市形态将增加居民患糖尿病的风险[42,43],主要通过两种途径:①蔓延的城市形态导致了个体工作地点和居住地点的分离,从而造成通勤距离增加,间接导致步行和骑行的通勤方式减少[42,44];②蔓延的城市中,公共绿地往往被建筑取代,减少了可供居民体力活动的户外空间[42,45],上述两种因素都将导致居民体力活动的减少,进而增加患糖尿病的风险。例如,相比于蔓延、机动车导向的美国城市,紧凑发展、步行和骑行导向的欧洲城市,其居民糖尿病患病风险更低[13,46,47]。
实证研究方面,Ewing等[13]基于美国某州的居民健康数据研究发现,以更紧凑的形态组织城市和郊区空间可能会抑制糖尿病等慢性病的增长态势。Stevenson等[47]基于健康影响评估框架及土地利用和交通方式选择模型,通过模拟墨尔本、波士顿、伦敦等6个城市的紧凑型城市的空间规划策略对交通方式选择和人群健康的影响,建议政府发展紧凑型城市,支持步行、自行车和低排放公共交通,可降低居民患糖尿病风险。Marshall等[48]基于美国加州健康调查数据,研究加州24个城市的街道网络特征和街道设计特征对居民健康的影响,发现街道网络越紧凑、连接越紧密、主干的车道越少,则居民患糖尿病的风险越低,这可能是由于紧凑且连通的街道可以促进居民主动出行,从而增加体力活动水平。
另一方面,城市蔓延过程中,居住在不同区位的居民对糖尿病相关服务设施的可达性不同,可能对糖尿病患病结果产生影响。例如,Madill等[20]对墨尔本市5万个综合住宅地址到糖尿病健康服务点的交通用时进行了测算,发现相比住在内城和近郊区的居民,居住在远郊区的居民前往糖尿病服务点的平均时间分别延长了2.5~23.2分钟(使用私家车)和12.5~43.2分钟(使用公共交通),可能导致远郊区居民糖尿病患病风险的增加。
2.3 路径三:族裔文化与居住隔离→生活方式和心理压力→糖尿病患病风险
族裔文化通过影响个体的生活方式(如健康理念、健康行为和治疗偏好等),进而影响个体糖尿病患病风险和患病结果[49,50]。
实证研究方面,糖尿病患者中,相比于白人,墨西哥裔美国人的饮食行为、社会规范和健康理念更佳,往往能更好地控制血糖[51]。同时,不少研究发现,西方城市中与族裔相关的居住隔离,能一定程度上解释糖尿病患病率在空间上的分布不均。例如,夏威夷日裔美国人社区的糖尿病患病率更高,很大程度上是由于饮食结构上过多摄入脂肪和动物蛋白[52];德克萨斯州的墨西哥裔美国人社区的糖尿病患病率更低,很大程度上由于社区居民体力活动水平更高和健康理念更佳[53]。
此外,由族裔导致的居住隔离可能会对少数族裔的生活方式和心理压力产生负面影响,导致其糖尿病患病风险升高[12,54]。
实证研究方面,Piccolo等[55]基于美国波士顿地区社区健康调查数据研究发现,由于少数族裔社区距离健康食品零售点较远导致谷物摄入量较低、族裔隔离导致心理压力升高等原因,黑人患2型糖尿病的概率是白人的2.89倍,西班牙裔是白人的1.48倍。Haynes-Maslow等[56]基于美国食品环境图集和数据研究发现,在高贫困和少数族裔较多的县中,每1000名居民增加1家便利店,将促进所在社区居民饮食结构偏向高脂肪,导致糖尿病患病率增加1.88%。LaVeist等[57]基于美国巴尔的摩西南综合社区健康数据研究发现,当非裔美国人和白人生活在混合社区时,他们的糖尿病患病率相似,证明了族裔混合社区策略对少数族裔糖尿病患病率的减缓作用。
2.4 路径四:通勤方式→交通性体力活动→糖尿病患病风险
城市空间布局中职住空间的邻近、公共交通的普及等,将促进居民在日常通勤中采用步行、骑行等积极的交通方式,有助于提高体力活动水平,进而降低患糖尿病风险[58,59]。
实证研究方面,Hu等[58]基于芬兰的14290名受访者的调查数据研究发现,每天步行或骑自行车的通勤时间达30分钟以上时,患2型糖尿病的风险降低34%。Sato等[59]基于日本8576名男性2000—2005年间的调查数据研究发现,步行上班时间超过21分钟的男性患2型糖尿病的概率比步行上班时间少于10分钟的男性低27%。Millett等[60]基于印度3902名受访者的数据研究发现,与乘坐私人小汽车上班的受访者相比,骑车上班的受访者患糖尿病风险低7%。Brinks 等[61]通过模拟德国积极出行交通政策,以预测糖尿病患病率,结果显示政策的实施将导致80岁前男性患2型糖尿病的风险降低6.4%,女性降低4.7%,这可能是由于增加公共交通可达性、自行车道等政策,可促进居住体力活动水平。
3 社区环境对糖尿病患病风险的影响路径评述
社区环境对个体糖尿病患病风险的影响,可以概括为五条路径:①社区食物环境通过影响个体饮食行为,进而影响糖尿病患病风险;②社区体力活动空间通过个体居民体力活动水平,进而影响糖尿病患病风险;③社区及周边绿色空间通过对个体释放心理压力和体力活动水平产生影响,进而影响糖尿病患病风险;④社区社会环境通过影响个体心理压力和体力活动水平,进而影响个体适应负荷和应激激素,从而影响糖尿病患病风险;⑤社区噪音通过睡眠环境影响个体心理压力和睡眠情况,进而导致个体代谢紊乱和胰岛素敏感性降低,最终影响糖尿病患病风险。
3.1 路径一:社区食物环境→饮食行为→糖尿病患病风险
社区食物环境指社区及其周边食品零售点的分布,包括食品零售点的类型、密度和可达性等[62]。食物环境将从以下两方面影响个体饮食行为。
一方面,居住在健康食品零售点(如大型超市、市场等售卖新鲜蔬菜水果的零售点)密度和可达性高的社区的居民,饮食结构中高纤维食品比例更高,有利于促进葡萄糖代谢,进而降低患2型糖尿病的风险[11,63]。
实证研究方面, Salois等[11]基于美国食品环境地图集和农业普查数据研究发现,每1000人增加1个农贸市场,则周边社区居民的糖尿病发病率将降低0.78%。Herrick等[63]基于美国中西部卫生系统的员工健康数据研究发现,生活在超市密度较高的社区居民,糖尿病患病风险较低。Menezes等[64]基于墨西哥2808份健康营养调查数据研究发现,相比生活在蔬菜水果店密度保持稳定的社区,生活在蔬菜水果店密度下降社区的成年人患糖尿病的风险更高。Wiki等基于新西兰糖尿病全国性数据研究发现,奶制品、水果蔬菜商店的可达性较高的社区对2型糖尿病有“保护作用”[65]。
另一方面,居住在不健康食品零售点(如快餐店、便利店)密度和可达性高的社区的居民,糖摄入和脂肪摄入更多,患2型糖尿病风险更高。
实证研究方面,Ntarladima等[66]基于荷兰全国健康调查数据研究发现,居住地400米缓冲区范围内的快餐店密度与糖尿病患病风险显著正相关,1000米和1500米缓冲区范围内的快餐店密度与糖尿病患病风险无相关性。Bodicoat等[67]基于英国开展的三项糖尿病筛查数据研究显示,如果每个社区每增加2快餐店,就会增加1个糖尿病病例。Sarkar等[68]基于英国347551名年龄在37~73岁的人群调查研究发现,相比居住地附近没有快餐店的居民,居住地1公里范围内有快餐店的居民患2型糖尿病的风险高11%。
3.2 路径二:社区体力活动空间→体力活动→糖尿病患病风险
规律的体力活动可以通过增加能量消耗、提高胰岛素敏感性来降低个体患糖尿病的风险 [14,69]。居住在体育娱乐设施和绿色空间较多、可步行性较高的社区,则个体更有可能从事体力活动,进而降低糖尿病发生的风险[70,71]。
一方面,体育娱乐设施和绿色空间的分布将影响居民的休闲娱乐性体力活动(Recreational physical activities)水平,进而影响居民患糖尿病的风险。并且,体育娱乐设施和绿色空间的存在,能一定程度上弥补缺乏健康食物来源给居民患糖尿病造成的不利影响[72]。
实证研究方面,Myers等[14]基于美国疾病控制调查数据研究发现,个体糖尿病患病风险与社区及周边健身、娱乐设施密度呈显著负相关。Paquet等[21]基于美国西北阿德莱德健康研究数据研究显示,居住在公共开放空间较多的社区的受访者患前驱糖尿病的风险较低[⑨]。
另一方面,居住在可步行性较高的社区的居民,交通性体力活动水平更高,则患糖尿病的风险更低[70]。学界常用“3D”——密度(Density)、多样目的地(Diversity of destinations)和步行友好设计(Pedestrian friendly design)——来衡量社区可步行性[71]。
实证研究方面,India-Aldana等[73]基于4096629名美国退伍军人糖尿病风险研究数据发现,生活在密度较低的郊区和小城镇社区的受访者,较高的土地利用强度对糖尿病患病风险具有“保护作用”;但在人口密度较高的城市社区中,则土地利用强度与糖尿病患病风险没有相关性。这可能是由于公共交通为城市居民出行方式提供了另一个选择,居民可步行性可能会所有不同。Nguye等[74]基于美国犹他州的谷歌街景图像数据和医疗保健数据发现,居住在人行横道数量较少、可见公用电线较多,以及只有单一土地用途的居住用地属性的社区居民,居民糖尿病患病风险较高,这可能是由于较多的公用电线会影响社区美观感和安全感,从而降低居民出行意愿。Paquet等[21]基于美国西北阿德莱德健康数据研究发现,居住在建筑密度高、十字路口密度高、土地使用熵高的社区的居民,患糖尿病的风险较低。Booth等[70]基于加拿大多伦多移民数据研究发现,相比居住在高收入、高可步行性社区的新移民,居住在低收入、低可步行性社区的新移民糖尿病患病率高出三倍。Gibson等[75]利用仿真模型模拟了25年间美国北卡罗来纳州罗利地区可步行性社区规划对居民患糖尿病风险的影响,发现新规划将导致居民每日步行时间平均增加约17分钟,相应地糖尿病患病率将下降1.9%。
3.3 路径三:社区及周边绿色空间→心理压力→糖尿病患病风险[⑩]
绿色空间通过提供优美的自然景观及较好的空气质量,让使用者获得良好的视觉和心理体验,从而释放心理压力,降低糖尿病的患病风险[11][76]。
实证研究方面,Nguye等[74]基于美国犹他州的谷歌街景图像数据和医疗保健数据发现,社区周边的街道绿化程度较高,则居民糖尿病患病风险较低。Astell-Burt等[77]基于澳大利亚医疗保险数据,研究发现,当居住地1公里缓冲区的绿地率小于20%时,居民糖尿病患病率约为9.1%,但当绿地率超过40%时,糖尿病患病率下降至8.0%。Bodicoat等[78]基于英国的莱斯特郡2型糖尿病筛查研究数据发现,当用800米半径的缓冲区计算居住地周边绿色空间面积时,绿色空间对2型糖尿病患病风险无显著影响;当使用3~5公里半径缓冲区时,绿色空间面积与2型糖尿病患病风险呈显著负相关。Dalton等[72]基于欧洲癌症前瞻性调查数据研究显示,相比居住在绿色空间较少社区的居民,居住在最“绿色”社区(社区绿地面积占社区总土地面积的1/4以上)的居民患糖尿病的风险将降低19%,且这种影响在80岁以上的老人中尤其明显。Muller等[79]基于德国多特蒙德的1312名25~74岁的受访者数据研究发现,社区绿地比例、游憩区位商(RLQ)[12]与2型糖尿病患病率显著负相关,居住地距离公园0.8公里以外与2型糖尿病患病率显著正相关。
3.4 路径四:社区社会环境→心理压力和体力活动→糖尿病患病率
社区社会环境,包括社区安全、集体效能和社会支持等,将通过影响居民的心理压力和体力活动水平,进而影响居民患糖尿病的风险[80,81],这种效应在低收入社区中更为常见。居住在低收入社区的居民,因缺乏就业机会和服务设施等因素,往往认为被社会抛弃,从而不遵守社会规范、造成混乱,反应为社区物质障碍(Physical disorder)(如烂尾楼、噪音、涂鸦、破坏行为等)和社会混乱(Social disorder)(如在公共场所游荡,酗酒或吸毒等)。上述混乱使社区内其他居民长期处于恐惧、不安全的压力状态下,一方面直接导致糖尿病的患病风险增加;另一方面导致居民减少户外体力活动,间接导致糖尿病患病风险增加[82]。
实证研究方面,Dendup等[83]基于澳大利亚新南威尔士州健康数据研究发现,社区居民感知到的犯罪率越强,则个体患2型糖尿病患病风险越高,这很可能是由于居民不倾向于户外体力活动导致的。另一方面,良好的社区社会环境有利于增强社区社会支持、社会凝聚力和集体效能,从而减缓个体心理压力、促进个体进行体力活动的意愿,最终降低糖尿病的患病风险[84]。例如,集体效能高的社区往往人际信任更高,这使得居民更倾向于体力活动,并促进健康行为在社区的传播。Gebreab等[85]基于美国杰克逊心脏调查研究数据发现,社区凝聚力越强,糖尿病患病风险较低,这可能是由于:一方面居民得到家庭、朋友和邻里等支持,从而缓解了居民心理压力,一方面社区凝聚力能够促进居民积极的健康行为。
3.5 路径五:噪音→睡眠环境→心理压力和睡眠障碍→糖尿病患病风险
噪音属于环境应激源(stressor)[13],当个体受到噪音干扰时会产生应激反应,如刺激下丘脑-垂体-肾上腺轴的激活和产生过量的糖皮质激素(glucocorticoid)[14]等,从而导致血压、心率上升[86,87],进而增加心理压力、影响睡眠质量,导致代谢紊乱(如刺激食欲增加)和胰岛素敏感性降低,从而增加糖尿病患病风险[88]。
实证研究方面,Sorensen等[89]基于丹麦饮食、癌症和健康队列研究发现,年平均道路交通噪声每高出10分贝时,社区居民糖尿病患病风险将增加8%~11%,这种效应对于女性尤其最为明显。Heidemann等[90]基于德国国家健康调查数据研究发现,相比居住在交通环境安静社区的居民,居住在极度吵闹繁忙道路附近的社区居民患2型糖尿病风险将增加2倍。Charlotte等[91]基于一项加拿大不列颠哥伦比亚省380738名中老人的前瞻性队列研究发现,噪声暴露将导致糖尿病患病风险增加8%,尤其在华裔和南亚裔群体中最为明显。
4 讨论
4.1 当前研究的不足
总体而言,西方学界关于城市和社区环境对糖尿病的研究开展较早,已形成一定共识,但仍存在以下不足。第一,大多数研究仅聚焦于其中的一条或两条影响路径,尚缺乏研究全面揭示城市和社区各个要素对糖尿病患病风险的复杂、交织影响,亦难以回答哪条路径对糖尿病患病风险起着决定性作用。第二,由于各个国家对于城市的界定标准不同,导致城市人口密度、设施水平等存在较大差异,由于数据获取的难度,目前尚缺少跨国的、系统性的城市环境评估指标与糖尿病的关联性研究。第三,与众多环境健康效应研究面临的问题相似,城市和社区环境对糖尿病的研究仍面临着横断面数据难以反映环境影响的滞后性、居住自选择的干扰难以排除等问题。最后,多数研究对个体健康态度、理念等干扰因素的影响缺乏控制,将可能造成研究结果偏差。
4.2 未来我国研究方向
西方研究为我国学界提供了重要的理论线索和方法基础。未来我国研究除了对上述研究不足进行回应外,还需考虑到我国城市与西方的不同。例如,我国城市发展阶段与西方国家不同,城市化水平提升对于糖尿病患病风险的促进作用是否仍然存在?相比西方城市,我国城市密度显著更高,公共交通使用比例也更高,城市形态对糖尿病患病风险是否存在相似的影响?我国城市中不存在由于族裔问题导致的居住隔离和歧视,健康食品零售点和体力活动空间资源的分布更加均衡,与糖尿病患病风险显著相关的社区特征是否不同于西方?我国城市中存在大量的封闭小区,一方面在小区内部提供了排他的、独立运行管理的体力活动空间,有可能提升居民的体力活动水平,降低糖尿病患病风险;另一方面,有限的出入口也降低了社区外部服务设施的步行可达性,有可能降低居民的步行出行意愿,增加糖尿病患病风险。封闭小区与糖尿病患病风险的关联有待我国实证研究的揭示。
4.3 优化城市及社区治理减缓糖尿病的政策建议
西方相关实践经验较为丰富,为我国未来城市和社区治理提供了参考,例如:①在健康相关的环境公共政策中,增加专门针对糖尿病的目标和活动计划,并对政策实行前后,居民的糖尿病患病率进行追踪、研究。②推行旨在减缓糖尿病患病风险的设计指南,通过设计创造鼓励体力活动的环境、促进健康饮食的环境。③以社区为单元开展建成环境优化和健康生活方式引导、教育和宣传等工作,并将糖尿病环境风险因素纳入健康社区规划要素。需要强调的是,中西方城市发展背景、建成环境特征、社会环境特征等方面具有较大的差异性,西方的部分经验不能直接应用指导我国实践,需要基于我国实证研究进行有选择地借鉴。
5 结论
城市和社区环境对糖尿病患病风险的影响是近年来西方公共卫生、城市规划和地理学交叉领域研究的热门议题之一。本文系统梳理了西方实证研究,基于“环境风险要素-个体中介行为-糖尿病患病风险”的研究框架,梳理出城市和社区环境影响糖尿病患病风险的9条路径。其中,城市层面的4条:①城市化水平通过改变个体的体力活动、饮食结构等生活方式,影响糖尿病患病风险;②城市形态通过改变个体体力活动水平,影响糖尿病患病风险;③族裔文化与居住隔离通过影响个体的生活方式和心理压力,进而影响个体适应负荷与应激激素及体力活动水平,最终影响糖尿病患病风险;④通勤方式通过影响交通性体力活动,影响糖尿病患病风险。社区层面的5条:①社区食物环境通过影响个体饮食行为,影响糖尿病患病风险;②社区体力活动空间通过个体居民体力活动水平,影响糖尿病患病风险;③社区及周边绿色空间通过影响个体心理压力和体力活动水平,影响糖尿病患病风险;④社区社会环境通过影响个体心理压力和体力活动水平,进而影响个体适应负荷和应激激素,从而影响糖尿病患病风险;⑤社区噪音通过睡眠环境影响个体心理压力和睡眠,进而导致个体代谢紊乱和胰岛素敏感性降低,最终影响糖尿病患病风险。在此基础上,讨论当前研究的不足,并提出未来我国研究方向和优化城市及社区治理减缓糖尿病的政策建议。
利益冲突: 作者声明无利益冲突。
[⑤] *通讯作者 Corresponding author:盛明洁,mingjie.sheng@tju.edu.cn
收稿日期:2022-06-03; 录用日期:2022-08-11; 发表日期:2023-03-28
基金项目:首都区域空间规划研究北京市重点实验室开放课题“京津冀特大城市地区社区建成环境与社会经济特征对健康的影响研究”(CLAB202008)资助
① 资料来源:《中国2型糖尿病防治指南(2020年版)》
② 资料来源:《第10版IDF糖尿病地图》
[⑥] 例如:扩大中心区自行车道网络、提供充足的绿色和休闲空间、创造出行友善的生态街道等。
[⑦] 除此之外,糖尿病类型还包括妊娠糖尿病、其他类型糖尿病(单基因糖尿病、胰腺外分泌疾病引起的糖尿病、药物或化学物品引起的糖尿病、由病毒感染引起的与细胞破坏有关的感染性糖尿病等)。
[⑧] 集聚综合指数(agglomeration index)是对人口密度、规模和到最近城市的出行时间(travel time)的综合衡量,旨在量化聚落集中的程度。聚落集中程度越高,则集聚综合指数值越大。
[⑨] 前驱糖尿病是指在患有高血糖症和低血糖症的患者中存在的葡萄糖代谢障碍,但其并未达到标准的2型糖尿病的诊断标准。
[⑩] 绿色空间既可以提供体力活动场所,也可以释放心理压力。关于绿色空间对体力活动的影响,已经在路径二中讨论过,因此本节只探讨社区及周边绿色空间对心理压力的影响。
[11] 心理压力通过刺激个体适应负荷和应激激素上升,从而加大个体患糖尿病风险。
[12] 游憩区位商(RLQ):即Recreation Location Quotient,可根据社区的人口规模来评估社区绿色空间,计算方法为:(社区总绿地面积/社区总人口数量)/(市域总绿地面积/市域总人口数量),该比值>1时,表示社区绿地面积相对于城市平均绿地面积较高;比值<1时,表示社区绿地面积相对于城市平均绿地面积较低。该指标值越大,则社区绿地人居绿地面积情况越好。
[13] 应激源:是指向机体提出适应要求,并可引起应对反应、稳态失衡的客观变化的环境事件或情境,也可称为刺激物或刺激。
[14] 糖皮质激素(glucocorticoid)会抑制胰腺β细胞的胰岛素分泌,降低肝脏、骨骼肌和脂肪组织中的胰岛素敏感性。
参考文献(References)
[1] Allender S, Foster C, Hutchinson L, et al. Quantification of urbanization in relation to chronic diseases in developing countries: A systematic review[J]. Journal of Urban Health, 2008, 85(6): 938-951.
https: //doi. org/10. 1007/s11524-008-9325-4
[2] Popkin B M, Gordon-Larsen P. The nutrition transition: Worldwide obesity dynamics and their determinants[J]. International Journal of Obesity, 2004, 28(S3): S2-9.
https: //doi. org/10. 1038/sj. ijo. 0802804
[3] 张毓辉, 万泉, 柴培培, 等. 我国糖尿病医疗费用及筹资负担研究[J]. 中国卫生经济, 2017, 36(04): 17-19.
https: //doi. org/10. 7664/CHE20170404
[4] Gassasse Z, Smith D, Finer S, et al. Association between urbanisation and type 2 diabetes: An ecological study [J]. BMJ Global Health, 2017, 2(4).
https: //doi. org/10. 1136/bmjgh-2017-000473
[5] 李哲, 刘剑君, 韩晓燕, 等. 城市化对慢性非传染性疾病影响的相关研究现状[J]. 中国慢性病预防与控制, 2019, 27(01): 61-64, 68.
https: //doi. org/10. 16386/j. cjpccd. issn. 1004-6194. 2019. 01. 017
[6] 周素红, 张琳, 林荣平. 地理环境暴露与公众健康研究进展[J]. 科技导报, 2020, 38(07): 43-52.
[7] Keen H, Track N S. Age of onset and inheritance of diabetes: the importance of examining relatives[J]. Diabetologia, 1968, 4(6): 317-321.
https: //doi. org/10. 1007/BF01211765
[8] Razykov A, Liberman I S. Incidence of glycosuria among the population of different age groups living in Andizhan and in the Andizhan district[J]. Problemy endokrinologii, 1978, 24(1): 16-21.
[9] Gavin J R. Diabetes in minorities: Reflections on the medical dilemma and the healthcare crisis[J]. Transactions of the American Clinical & Climatological Association, 1996, 107: 213.
[10] Gittelsohn J, Harris S B, et al. Use of ethnographic methods for applied research on diabetes among the Ojibway-Cree in northern Ontario[J]. Health Education Quarterly, 1996, 23(3): 356-382.
https: //doi. org/10. 1177/109019819602300307
[11] Salois M J. Obesity and diabetes, the built environment, and the ‘local’ food economy in the United States, 2007[J]. Economics & Human biology, 2012, 10(1): 35-42.
https: //doi. org/10. 1016/j. ehb. 2011. 04. 001
[12] Williams D R, Collins C. Racial residential segregation: A fundamental cause of racial disparities in health[J]. Public Health Reports, 2001, 116(5): 404-416.
https: //doi. org/10. 1016/S0033-3549(04)50068-7
[13] Ewing R, Meakins G, Hamidi S, et al. Relationship between urban sprawl and physical activity, obesity, and morbidity-Update and refinement[J]. Health & Place, 2014, 26: 118-126.
https: //doi. org/10. 1016/j. healthplace. 2013. 12. 008
[14] Myers C A, Slack T, Broyles S T, et al. Diabetes prevalence is associated with different community factors in the diabetes belt versus the rest of the United States [J]. Obesity, 2017, 25(2): 452-459.
https: //doi. org/10. 1002/oby. 21725
[15] Murphy D, Chapel T, Clark C. Moving diabetes care from science to practice: The evolution of the National Diabetes Prevention and Control Program[J]. Annals of Internal Medicine. 2004, 140(11): 978-984.
https: //doi. org/10. 7326/0003-4819-140-11-200406010-00040
[16] Bjärås G, Ahlbom A, et al. Strategies and methods for implementing a community-based diabetes primary prevention program in Sweden[J]. Health Promotion International. 1997, 12(2): 151-160.
https: //doi. org/10. 1093/heapro/12. 2. 151
[17] Langwell K, Keene C, Zullo M, et al. An American Indian Community implements the chronic care model: Evolution and lessons learned[J]. Health Promotion Practice, 2014, 15(2 Suppl): 23S-28S.
https: //doi. org/10. 1177/1524839914544171
[18] Amuda A T, Berkowitz S A. Diabetes and the built environment: Evidence and policies[J]. Current Diabetes Reports, 2019, 19(7):
https: //doi. org/10. 1007/s11892-019-1162-1
[19] Pasala S K, Rao A A, Sridhar G R. Built environment and diabetes[J]. International Journal of Diabetes In Developing Countries, 2010, 30(2): 63-68.
https: //doi. org/10. 4103/0973-3930. 62594
[20] Madill R, Badland H, Mavoa S, et al. Comparing private and public transport access to diabetic health services across inner, middle, and outer suburbs of Melbourne, Australia[J]. BMC Health Services Research, 2018, 18.
https: //doi. org/10. 1186/s12913-018-3079-9
[21] Paquet C, Coffee N T, et al. Food environment, walkability, and public open spaces are associated with incident development of cardio-metabolic risk factors in a biomedical cohort[J]. Health & Place, 2014, 28: 173-176.
https: //doi. org/10. 1016/j. healthplace. 2014. 05. 001
[22] IDF DIABETES ATLAS Ninth edition 2019[R]. Brussels: International Diabetes Federation, 2019.
[23] Kahn S E, Hull R L, Utzschneider K M. Mechanisms linking obesity to insulin resistance and type 2 diabetes [J]. Nature, 2006, 444(7121): 840-846.
https: //doi. org/10. 1038/nature05482
[24] Use of Glycated Haemoglobin(HbA1c)in the Diagnosis of Diabetes Mellitus. Geneva: World Health Organization, 2011.
[25] Emilie A, Peter A, Johan H, et al. Type 2 diabetes incidence and socio-economic position: a systematic review and meta-analysis[J]. International Journal of Epidemiology, 2011(3): 804.
https: //doi. org/10. 1093/ije/dyr029
[26] Hu F B. Globalization ofdiabetes: The role of diet, lifestyle, and genes[J]. Diabetes Care, 2011, 34(6): 1249-1257.
https: //doi. org/10. 2337/dc11-0442
[27] Dong G, Qu L, Gong X, et al. Effect of social factors and the natural environment on the etiology and pathogenesis of diabetes mellitus[J]. International Journal of Endocrinology, 2019(1): 1-7.
https: //doi. org/10. 1155/2019/8749291
[28] Misra A, Vikram N K. Insulin resistance syndrome(metabolic syndrome)and obesity in Asian Indians: Evidence and implications[J]. Nutrition, 2004, 20(5): 482-491.
https: //doi. org/10. 1016/j. nut. 2004. 01. 020
[29] Lopez-Jaramillo P, Lopez-Lopez J, et al. Epidemiology of hypertension and diabetes mellitus in Latin America [J]. Current Hypertension Reviews, 2021, 17(2): 112-120.
https: //doi. org/10. 2174/1573402116999200917152952
[30] Jannasch F, Kroger J, Schulze M B. Dietary patterns and type 2 diabetes: A systematic literature review and meta-analysis of prospective studies[J]. Journal Of Nutrition, 2017, 147(6): 1174-1182.
https: //doi. org/10. 3945/jn. 116. 242552
[31] Bailey D P, Hewson D J, et al. Sitting time and risk of cardiovascular disease and diabetes: A systematic review and meta-analysis[J]. American Journal of Preventive Medicine, 2019, 57(3): 408-416.
https: //doi. org/10. 1016/j. amepre. 2019. 04. 015
[32] Barglow P, Hatcher R, Edidin D V, et al. Stress and metabolic control in diabetes: psychosomatic evidence and evaluation of methods[J]. Psychosomatic Medicine, 1984, 46(2): 127-144.
https: //doi. org/10. 1097/00006842-198403000-00005
[33] Neamat-Allah J, Barrdahl M, et al. Weight cycling and the risk of type 2 diabetes in the EPIC-Germany cohort [J]. Diabetologia, 2015, 58(12): 2718-2725.
https: //doi. org/10. 1007/s00125-015-3755-9
[34] Liu SY, Walter S, et al. Genetic vulnerability to diabetes and obesity: does education offset the risk? [J]. Social Science & Medicine, 2014, 127: 150-158.
https: //doi. org/10. 1016/j. socscimed. 2014. 09. 009
[35] Dinca-Panaitescu S, Dinca-Panaitescu M, et al. Diabetes prevalence and income: Results of the Canadian Community Health Survey[J]. Health Policy, 2011, 99(2): 116-123.
https: //doi. org/10. 1016/j. healthpol. 2010. 07. 018
[36] Carlsson S, Andersson T, et al. Incidence and prevalence of type 2 diabetes by occupation: Results from all Swedish employees[J]. Diabetologia, 2020, 63(1): 95-103.
https: //doi. org/10. 1007/s00125-019-04997-5
[37] Piwernetz K, Home, et al. Monitoring the targets of the St Vincent Declaration and the implementation of quality management in diabetes care: The diabcare initiative [J]. Diabetes Medicine, 1993, 10(4): 371-377.
https: //doi. org/10. 1111/j. 1464-5491. 1993. tb00083. x
[38] Lovic D, Piperidou A, et al. The growing epidemic of diabetes mellitus[J]. Current Vascular Pharmacology, 2020, 18(2): 104-109.
https: //doi. org/10. 2174/1570161117666190405165911
[39] Colagiuri R, Colagiuri S, et al. The answer to diabetes prevention: science, surgery, service delivery, or social policy? [J]. American Journal Public Health, 2006, 96(9): 1562-1569.
https: //doi. org/10. 2105/AJPH. 2005. 067587
[40] Katchunga P B, Cikomola J, Tshongo C, et al. Obesity and diabetes mellitus association in rural community of Katana, South Kivu, in Eastern Democratic Republic of Congo: Bukavu Observcohort study results[J]. BMC Endocrine Disorders, 2016, 16.
https: //doi. org/10. 1186/s12902-016-0143-5
[41] Jorgensen M E, Borch-Johnsen K, et al. Diabetes in Greenland and its relationship with urbanization[J]. Diabetic Medicine, 2012, 29(6): 755-760.
https: //doi. org/10. 1111/j. 1464-5491. 2011. 03527. x
[42] Kelly-Schwartz A C, Stockard J, Doyle S, et al. Is sprawl unhealthy? A multilevel analysis of the relationship of metropolitan sprawl to the health of individuals[ J]. Journal of Planning Education And Research, 2004, 24(2): 184-196.
https: //doi. org/10. 1177/0739456X04267713
[43] Chandrabose M, Rachele J N, Gunn L, et al. Built environment and cardio-metabolic health: systematic review and meta-analysis of longitudinal studies[J]. Obesity Reviews, 2019, 20(1): 41-54.
https: //doi. org/10. 1111/obr. 12759
[44] Pohanka M, Fitzgerald S. Urban sprawl and you: How sprawl adversely affects worker health[J]. Official Journal of the American Association of Occupational Health Nurses, 2004, 52(6): 242-246.
https: //doi. org/10. 1177/216507990405200605
[45] Lee I M, Ewing R, Sesso H D. The built environment and physical activity levels: The Harvard Alumni Health Study[J]. American Journal of Preventive Medicine, 2009, 37(4): 293-298.
https: //doi. org/10. 1016/j. amepre. 2009. 06. 007
[46] Mueller N, Daher C, Rojas-Rueda D, et al. Integrating health indicators into urban and transport planning: A narrative literature review and participatory process [J]. International Journal of Hygiene and Environmental Health, 2021, 235: 113772.
https: //doi. org/10. 1016/j. ijheh. 2021. 113772
[47] Stevenson, Mark, Thompson, et al. Land use, transport, and population health: estimating the health benefits of compact cities [J]. Lancet, 2016, 388(10062): 2925-2935.
https: //doi. org/10. 1016/S0140-6736(16)30067-8
[48] Marshall W E, Piatkowski D P, Garrick N W. Community design, street networks, and public health[J]. Journal of Transport & Health, 2014, 1(4): 326-340.
https: //doi. org/10. 1016/j. jth. 2014. 06. 002
[49] Brown A F, Ettner S L, Piette J, et al. Socioeconomic position and health among persons with diabetes mellitus: A conceptual framework and review of the literature[ J]. Epidemiologic Reviews, 2004, 26: 63-77.
https: //doi. org/10. 1093/epirev/mxh002
[50] Walsh M E, Katz M A, Sechrest L. Unpacking cultural factors in adaptation to type 2 diabetes mellitus[J]. Medical Care, 2002, 40(1): 129-139.
https: //doi. org/10. 1097/00005650-200201001-00014
[51] Crespo C J, Smit E, Carter-Pokras O, Andersen R. Acculturation and leisure-time physical inactivity in Mexican American adults: results from NHANES III, 1988- 1994[J]. American Journal Public Health, 2001, 91(8): 1254-1257.
https: //doi. org/10. 2105/AJPH. 91. 8. 1254
[52] Huang B, Rodriguez B L, Burchfiel C M, et al. Acculturation and prevalence of diabetes among Japanese-American men in Hawaii[J]. American Journal of Epidemiology, 1996, 144(7): 674-681.
https: //doi. org/10. 1093/oxfordjournals. aje. a008980
[53] Sundquist J, Winkleby M. Country of birth, acculturation status and abdominal obesity in a national sample of Mexican-American women and men[J]. International Journal Epidemiology, 2000, 29(3): 470-477.
https: //doi. org/10. 1093/ije/29. 3. 470
[54] Hogue K. Issegregation bad for your health? [J]. Epidemiologic Reviews, 2009, 31(1): 178-194.
https: //doi. org/10. 1093/epirev/mxp001
[55] Piccolo R S, Duncan D T, Pearce N, et al. The role of neighborhood characteristics in racial/ethnic disparities in type 2 diabetes: Results from the Boston Area Community Health(BACH)Survey[J]. Social Science & Medicine, 2015, 130: 79-90.
https: //doi. org/10. 1016/j. socscimed. 2015. 01. 041
[56] Haynes-Maslow L, Leone L A. Examining the relationship between the food environment and adult diabetes prevalence by county economic and racial composition: an ecological study[J]. BMC Public Health, 2017, 17.
https: //doi. org/10. 1186/s12889-017-4658-0
[57] Laveist T A, Thorpe R J, Galarraga J E, et al. Environmental and socio-economic factors as contributors to racial disparities in diabetes prevalence[J]. Journal of General Internal Medicine, 2009, 24(10): 1144-1148.
https: //doi. org/10. 1007/s11606-009-1085-7
[58] Hu G, Qiao Q, Silventoinen K, et al. Occupational, commuting, and leisure-time physical activity in relation to risk for Type 2 diabetes in middle-aged Finnish men and women[J]. Diabetologia, 2003, 46(3): 322-329.
https: //doi. org/10. 1007/s00125-003-1031-x
[59] Sato K K, Hayashi T, Kambe H, et al. Walking to work is an independent predictor of incidence of type 2 diabetes in Japanese men: The kansai healthcare study[J]. Diabetes Care, 2007, 30(9): 2296-2298.
https: //doi. org/10. 2337/dc07-0090
[60] Millett C, Agrawal S, Sullivan R, et al. Associations betweenactive travel to work and overweight, hypertension, and diabetes in India: A cross-sectional study[J]. PLoS Medicine, 10, 6(2013-6-11), 2013, 10(6): e1001459.
https: //doi. org/10. 1371/journal. pmed. 1001459
[61] Brinks R, Hoyer A, Kuss O, et al. Projected effect of increasedactive travel in German urban regions on therisk of type 2 diabetes[J]. PLOS One, 2015, 10(4).
https: //doi. org/10. 1371/journal. pone. 0122145
[62] Bryant L M, Eicher-Miller H A, Korucu I, et al. Associationsbetween subjective and objective measures of thecommunity food environment and executive function inearly childhood[J]. Nutrients, 12(7).
https: //doi. org/10. 3390/nu12071944
[63] Herrick C J, Yount B W, Eyler A A. Implications of supermarketaccess, neighbourhood walkability and povertyrates for diabetes risk in an employee population[J]. Public Health Nutrition, 2016, 19(11): 2040-2048.
https: //doi. org/10. 1017/S1368980015003328
[64] Menezes M, Ferrer C P, Auchincloss A H, et al. Longitudinalchanges in the retail food environment inMexico and their association with diabetes[J]. Health& Place, 2020, 66: 102461.
https: //doi. org/10. 1016/j. healthplace. 2020. 102461
[65] Wiki J, Kingham S, Campbell M. Ageospatial analysisof type 2 diabetes mellitus and the food environment inurban New Zealand[J]. Social Science & Medicine, 2020: 113231.
https: //doi. org/10. 1016/j. socscimed. 2020. 113231
[66] Ntarladima A M, Karssenberg D, Poelman M, et al. Associationsbetween the fast-food environment and diabetesprevalence in the Netherlands: A cross-sectionalstudy[J]. The Lancet Planetary Health, 2022, 6(1): e29-e39.
https: //doi. org/10. 1016/S2542-5196(21)00298-9
[67] Bodicoat D H, Carter P, Comber A, et al. Is the numberof fast-food outlets in the neighbourhood related toscreen-detected type 2 diabetes mellitus and associatedrisk factors? [J]. Public health nutrition, 2015, 18(9): 1698-1705.
https: //doi. org/10. 1017/S1368980014002316
[68] Sarkar C, Webster C, Gallacher J. Are exposures toready-to-eat food environments associated with type 2diabetes? A cross-sectional study of 347-551 UKBiobank adult participants[J]. The Lancet PlanetaryHealth, 2018, 2(10): e438-e450.
https: //doi. org/10. 1016/S2542-5196(18)30208-0
[69] Aune D, Norat T, Leitzmann M, et al. Physical activityand the risk of type 2 diabetes: A systematic review anddose-response meta-analysis[J]. European Journal ofEpidemiology, 2015, 30(7): 529-542.
https: //doi. org/10. 1007/s10654-015-0056-z
[70] Booth G L, Creatore M I, Moineddin R, et al. Unwalkableneighborhoods, poverty, and the risk of diabetes amongrecent immigrants to Canada compared withlong-term residents[J]. Diabetes Care, 2013, 36(2): 302-308.
https: //doi. org/10. 2337/dc12-0777
[71] Kowaleski-Jones L, Zick C, Smith K R, et al. Walkableneighborhoods and obesity: Evaluating effects with apropensity score approach[J]. SSM-Population Health, 2018, 6: 9-15.
https: //doi. org/10. 1016/j. ssmph. 2017. 11. 005
[72] Dalton A, Jones A, Sharp S J, et al. Residential neighbourhoodgreenspace is associated with reduced risk ofincident diabetes in older people: A prospective cohortstudy[J]. BMC Public Health, 2016, 16(1): 1171.
https: //doi. org/10. 1186/s12889-016-3833-z
[73] India-Aldana S, Kanchi R, Adhikari S, et al. Impact ofland use and food environment on risk of type 2 diabetes: A national study of veterans, 2008-2018[J]. EvnironmentalReserach, 2022, 122: 113-146.
https: //doi. org/10. 1016/j. envres. 2022: 113146
[74] Nguyen Q C, Belnap T, Dwivedi P, et al. Google streetview images as predictors of patient health outcomes, 2017-2019[J]. Big Data Cogn. Comput. 2022, 6(1): 15.
https: //doi. org/10. 3390/bdcc6010015
[75] Gibson J M, Rodriguez D, Dennerlein T, et al. Predictingurban design effects on physical activity and publichealth: A case study[J]. Health& Place, 2015, 35: 79-84.
https: //doi. org/10. 1016/j. healthplace. 2015. 07. 005
[76] Hackett R A, Steptoe A. Type 2 diabetes mellitus andpsychological stress: A modifiable risk factor[J]. NatureReviews Endocrinology, 2017, 13(9): 547-560.
https: //doi. org/10. 1038/nrendo. 2017. 64
[77] Astell-Burt T, Feng X, Kolt G S. Is neighborhood greenspace associated with a lower risk of type 2 diabetes?Evidence from 267, 072 Australians[J]. Diabetes Care, 2014, 37(1): 197-201.
https: //doi. org/10. 2337/dc13-1325
[78] Bodicoat D H, O'Donovan G, et al. The association betweenneighbourhood greenspace and type 2 diabetes ina large cross-sectional study[J]. BMJ Open, 2014, 4(12).
https: //doi. org/10. 1136/bmjopen-2014-006076
[79] Müller G, Harhoff R, Rahe C, et al. Inner-city greenspace and its association with body mass index andprevalent type 2 diabetes: A cross-sectional study in anurban German city[J]. BMJ Open, 2018, 8(1).
https: //doi. org/10. 1136/bmjopen-2017-019062
[80] Smalls B L, Gregory C M, Zoller J S, et al. Effect ofneighborhood factors on diabetes self-care behaviors inadults with type 2 diabetes[J]. Diabetes Research &Clinical Practice, 2014, 106(3): 435-442.
https: //doi. org/10. 1016/j. diabres. 2014. 09. 029
[81] Gebreab S Y, Hickson D A, Sims M, et al. Neighborhoodsocial and physical environments and type 2 diabetesmellitus in African Americans: The Jackson heartstudy[J]. Health & Place, 2017, 43: 128-137.
https: //doi. org/10. 1016/j. healthplace. 2016. 12. 001
[82] Steve S L, Tung E L, Schlichtman J J, et al. Socialdisorderin adults with type 2 diabetes: Building on race, place, and poverty[J]. Current Diabetes Reports, 2016, 16(8): 1-9.
https: //doi. org/10. 1007/s11892-016-0760-4
[83] Dendup T, Astell-Burt T, Feng X. Residential self-selection, perceived built environment and type 2 diabetesincidence: A longitudinal analysis of 36, 224 middle toolder age adults[J]. Health & Place, 2019, 58: 102154.
https: //doi. org/10. 1016/j. healthplace. 2019. 102154
[84] Ingram M, Mayorga M T, Mel, et al. The animadoraproject: Identifying factors related to the promotion ofphysical activity among Mexican Americans with diabetesHHS public access[J]. American journal ofhealth promotion, 2019, 23(6): 396-402.
https: //doi. org/10. 4278/ajhp. 08021915
[85] Gebreab S Y, Hickson D A, et al. Neighborhood socialand physical environments and type 2 diabetes mellitusin African Americans: The Jackson Heart Study[J]. Health Place, 2018, 43: 128-137.
https: //doi. org/10. 1016/j. healthplace. 2016. 12. 001
[86] Lusk S L, Gillespie B, Hagerty B M, et al. Acuteeffectsof noise on blood pressure and heart rate[J]. Archivesof Environmental Health An International Journal, 2004, 59(8): 392-399.
https: //doi. org/10. 3200/AEOH. 59. 8. 392-399
[87] Ising H, Kruppa B. Health effects caused by noise: evidencein the literature from the past 25 years[J]. Noise& Health, 2004, 6(22): 5.
[88] Stamatakis K A, Punjabi N M. Effects of sleep fragmentationon glucose metabolism in normal subjects[J]. Sleep, 2013, 137(1): 95-101.
https: //doi. org/10. 1378/chest. 09-0791
[89] Sorensen M, Andersen Z J, Nordsborg R B, et al. Longtermexposure to road traffic noise and incident diabetes: A cohort study[J]. Environmental Health Perspectives, 2013, 121(2): 217-222.
https: //doi. org/10. 1289/ehp. 1205503
[90] Heidemann C, Niemann H, Paprott R, et al. Residentialtraffic and incidence of Type 2 diabetes: The Germanhealth interview and examination surveys[J]. DiabeticMedicine, 2014, 31(10): 1269-1276.
https: //doi. org/10. 1111/dme. 12480
[91] Charlotte C, Hind S, Lillian T, et al. Association oflong-term exposure to transportation noise and trafficrelatedair pollution with the incidence of diabetes: Aprospective cohort study[J]. Environmental HealthPerspectives, 2017, 125(8): 087025.
https: //doi. org/10. 1289/EHP1279
A Review of Research on the Impact Path of Western Urban and Community Environments on the Risk of Diabete
(1. School of Architecture, Tianjin University, Tianjin 300072, China
2. Institute of Medical Biotechnology, Chinese Academy of Medical Sciences, Beijing 100050, China)
Abstract: The number of people with diabetes in China reached 116 million in 2019, ranking first in the world. Diabetes is a great threat to national health and socio-economic development, which requires multidisciplinary collaborative research and intervention. Based on this, this paper systematically reviews the empirical studies on the impact of urban and community environments on diabetes in western academic fields in recent years. This paper summarizes the impact path driven by influencing factors such as urbanization level, urban form, ethnic culture and residential isolation, as well as commuting mode at the city level, and that driven by influencing factors such as community food environment, community physical activity space, community and surrounding green space, community social environment, as well as noise at the community level. It is pointed out that the above-mentioned environmental factors have an indirect influence on the risk of diabetes mainly through influencing individual lifestyle, physical activity, dietary behavior, psychological stress, sleep and other behavioral and psychological factors. This paper is aimed at providing theoretical reference for the emerging empirical research on the impact of urban built environment on diabetes in China, and providing research support for Health China 2030 strategies.
Keywords: Urban environment, community environment, diabetes, dietary behaviors, physical activities
DOI: 10.48014/cgsr.20220602001
Citation: HAN Yuting, SHENG Mingjie, XUE Situ. A review of research on the impact path of western urban and community environments on the risk of diabetes[J]. Chinese Geography Sciences Review, 2023, 1(1): 31-45.