

有氧反硝化菌强化生物滤池深度处理尾水
(1. 滨州魏桥国科高等技术研究院, 滨州 256600
2. 河北科技大学环境科学与工程学院, 石家庄 050000
3. 内蒙古高速科技产业有限公司, 呼和浩特 010052
4. 中国科学院大学中丹学院, 北京 100049
5. 中国科学院大学资源与环境学院, 北京 100049)
摘要: 部分污水处理厂排放的尾水中总氮的浓度较高, 容易引起受纳水体的富营养化。本研究通过生物强化技术将有氧反硝化菌与反硝化生物滤池相结合, 使用活性污泥中分离得到的有氧反硝化菌株W30、Z66构建复合菌剂, 强化反硝化生物滤池, 考察复合菌剂的强化脱氮效果, 并通过高通量测序技术对生物强化后系统内的微生物群落结构进行分析。结果表明, 经16S rDNA测序分析, 菌株W30为Pannonibacter 属, 菌株Z66为Pseudomonas属; 生物强化后的反硝化生物滤池挂膜启动速度快, 自然充氧条件下TN的去除率较曝气条件下提高了9. 36%; 通过碳氮比及水力停留时间的单因素试验, 确定C/N=4. 27, HRT=1. 0h为滤池的最优工况; 高通量测序结果进一步表明, Pannonibacter和Pseudomonas两菌属在反硝化生物滤池中的占比由运行初期的0. 49%和2. 56%下降至运行130天后的0. 073%和0. 18%, 与Thauera、Dechlorobacter、Exiguobacterium等菌属形成稳定的脱氮系统。
关键词: 有氧反硝化菌, 复合菌剂, 反硝化生物滤池, 尾水深度处理, 微生物多样性
DOI: 10.48014/cesr.20221209001
引用格式: 张懿婷, 张楠, 闫高俊, 等. 有氧反硝化菌强化生物滤池深度处理尾水[J]. 中国生态环境保护进展, 2023, 1(2): 10-21.
文章类型: 研究性论文
收稿日期: 2021-12-14
接收日期: 2023-03-07
出版日期: 2023-06-28
0 引言
自然界中主要包括分子氮、有机氮化合物和无机氮化合物三种形式的氮,无机氮中的硝酸盐氮(N![]() -N)是一种在工业废水、地下水以及生活污水中均广泛存在的氮污染物[1],过量的硝酸盐氮不仅会造成水体污染,同时也会增加人体的患病风险,如蓝婴综合征、糖尿病、甲状腺、造血系统癌变等,严重威胁到人体健康[2]。检测显示,部分城镇污水厂的二级出水仍出现氮和磷等营养元素浓度高的问题[3],其中N
-N)是一种在工业废水、地下水以及生活污水中均广泛存在的氮污染物[1],过量的硝酸盐氮不仅会造成水体污染,同时也会增加人体的患病风险,如蓝婴综合征、糖尿病、甲状腺、造血系统癌变等,严重威胁到人体健康[2]。检测显示,部分城镇污水厂的二级出水仍出现氮和磷等营养元素浓度高的问题[3],其中N![]() -N浓度过高是引起二级出水TN不达标的主要原因,综合尾水排放标准不断提高及水质安全愈加凸显等各方面因素,进行二级出水深度脱氮处理的研究显得尤为必要。
-N浓度过高是引起二级出水TN不达标的主要原因,综合尾水排放标准不断提高及水质安全愈加凸显等各方面因素,进行二级出水深度脱氮处理的研究显得尤为必要。
Robertson[4]首次分离出有氧反硝化菌Thiosphaera pantotropha,打破了反硝化过程需在严格厌氧条件下脱氮这一传统理论,此后,国内外陆续分离出较多的有氧反硝化菌,主要包括的菌属有假单胞菌属(Pseudomonas)[5]、芽孢杆菌(Bacillus)[6]、不动杆菌属(Acinetobacter)、副球菌属(Paracoccus)[7]和产碱杆菌(Alcaligenes)[8]等,它们大多具有异养硝化能力,广泛分布于活性污泥、土壤、污水和粪便处理系统以及自然生态系统。有氧反硝化菌可以硝态氮为氮源,通过同化作用将其转化为细胞有机氮;也可以通过异化作用将氮素转化为含氮气体[9]。
生物强化技术主要是指将具有特定功能的菌群以生物强化方式投加到污水处理系统中[10],有氧反硝化菌具有目标污染物去除效率高、成本低、耐受负荷冲击性能强等优点,被广泛应用于污水生物脱氮过程。陈均利等[11]研究Alcaligenes faecalis WT14强化处理实际养猪废水时发现TN脱除率可达90%。吴丽红等[12]研究发现Bacillus cereus FH2在N![]() -N脱除方面具有显著成效,强化后的反应装置启动时间明显缩短。
-N脱除方面具有显著成效,强化后的反应装置启动时间明显缩短。
本试验针对有氧反硝化菌强化生物滤池在尾水深度处理过程中的脱氮效果展开研究,重点考察碳氮比(C/N)、曝气条件、水力停留时间(HRT)对系统污染物去除性能的影响,以确定最优的工艺运行参数,解决针对尾水中N![]() -N含量较高引起的TN出水不达标的问题,结合高通量测序结果明确微生物群落变化,对整体提高废水脱氮效率具有现实指导性意义,并为复合菌剂强化尾水深度处理工艺的应用、推广提供理论指导。
-N含量较高引起的TN出水不达标的问题,结合高通量测序结果明确微生物群落变化,对整体提高废水脱氮效率具有现实指导性意义,并为复合菌剂强化尾水深度处理工艺的应用、推广提供理论指导。
1 材料与方法
1.1 菌株及培养基
使用菌株为课题组前期筛选得到的W30(NCBI数据库编号为NMDCN00011ED)和Z66(NCBI数据库编号为NMDCN00011EE)两株有氧反硝化菌株。
LB液体培养基:蛋白胨10g·L-1,酵母提取物5g·L-1,NaCl:5g·L-1,pH=7.1~7.3,固体LB培养基则在此基础上加入2%琼脂;
有氧反硝化培养基(DM):KNO3:0.3609g·L-1,Na2HPO4·12H2O:10.55g·L-1,KH2PO4:1.5g·L-1,MgSO4·7H2O:0.2g·L-1,CH3COONa:1.3667g·L-1,0.2%(体积比)微量元素溶液。
DM微量元素溶液:EDTA-Na2:50.0g·L-1,ZnSO4·7H2O:2.2g·L-1,CaCl2:5.5g·L-1,MnCl2·4H2O:5.06g·L-1,FeSO4·7H2O:5.0g·L-1,CuSO4·5H2O:1.57g·L-1,CoCl2·6H2O:1.61g·L-1。
所有培养基配制完成后,均在121℃高温条件下灭菌20min。
1.2 试验装置及用水
本试验以上流式反硝化生物滤池作为生物强化的反应装置,如图1所示。滤池总高为150cm,总体积约为11L,有效容积5L(装填填料后),内径为10cm,生物过滤层填料系统中共设置4个出水口,分别位于距填料底部0cm、25cm、65cm、105cm处;在探究C/N、曝气条件和HRT对系统污染物去除性能的过程中均以出水口4作为采样口。
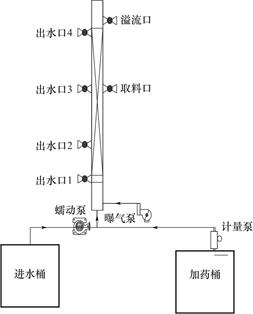
图1 反硝化生物滤池工艺装置图
Fig.1 Diagram of denitrifying biofilter process device
本试验在反硝化生物滤池的启动与运行阶段均采用生活污水处理A2O-MBR装置的尾水,出水水质见表1,在反应器挂膜启动阶段投加的污泥来自A2O-MBR的好氧区。
表1 A2O-MBR出水水质
Table 1 A2O-MBR effluent water quality
|
项目 |
浓度范围(mg·L-1) |
|
COD |
23~36 |
|
N |
0.17~0.94 |
|
N |
20.13~25.83 |
|
N |
0.35~1.19 |
|
TN |
22~39 |
|
TP |
3.87~2.85 |
|
DO |
4.03~5.17 |
|
pH |
7.02~7.16 |
1.3 复合菌剂复配比例优化
将两菌株按照七个不同的比例进行菌剂的复配,在以乙酸钠作为碳源,KNO3为唯一氮源,C/N为8∶1,pH为7.0的DM培养基中,按照W30∶Z66分别为5∶0、0∶5、4∶1、1∶4、3∶2、2∶3、1∶1的比例复配,以5%(v/v)的接种量接种至装有100mL培养基的250mL锥形瓶中,在30℃、80r·min-1的条件下培养,对比分析0h、12h、24h时不同复配比例对培养基中N![]() -N和TN浓度的变化情况。
-N和TN浓度的变化情况。
1.4 微生物群落结构分析
在生物滤池启动成功后,采用高通量测序技术对有氧反硝化菌剂强化后的反硝化生物滤池系统内的生物膜样本进行微生物群落结构及多样性分析。分别于第25天、第62天、第95天、第130天收集生物膜样品,依次以A、B、C、D命名。选取的引物为338F:5'-ACTCCTACGGGAGGCAGCAG-3',806R:5'-GGACTACHVGGGTWTCTAAT-3'。对细菌DNA的V3-V4区域进行PCR扩增并对其进行高通量测序。
1.5 测定项目及分析方法
COD采用国标重铬酸钾氧化法(GB 11914—1989)测定;硝氮(N![]() -N)采用紫外分光光度法 (HJ/T 346-200)测定;亚硝氮(N
-N)采用紫外分光光度法 (HJ/T 346-200)测定;亚硝氮(N![]() -N)采用N-(1-萘基)-乙二胺二盐酸盐分光光度法(GB 7493—1987)测定;总氮(TN)采用碱性过硫酸钾消解紫外分光光度法(HJ 636—2012)测定;TP采用钼锑分光光度法(GB3838—2002)[13],DO采用便携式溶解氧测定仪测定。
-N)采用N-(1-萘基)-乙二胺二盐酸盐分光光度法(GB 7493—1987)测定;总氮(TN)采用碱性过硫酸钾消解紫外分光光度法(HJ 636—2012)测定;TP采用钼锑分光光度法(GB3838—2002)[13],DO采用便携式溶解氧测定仪测定。
2 结果与结论
2.1 有氧反硝化菌株的鉴定
将课题组前期筛选得到的菌株W30[14]、Z66的测定序列与NCBI数据库中与已知种属的16S rRNA序列进行比较,利用MEGA X构建系统发育树,结果如图2所示,经鉴定W30与GenBank数据库中Pannonibacter phragmitetus的亲缘关系较近,与Pannonibacter phragmitetus strain RPS1的相似度高达100%,Z66菌株与Pseudomonas亲缘关系较近,与Pseudomonas mendocina strain ATCC 25411的相似度高达100%。
2.2 复合有氧反硝化菌剂的比例优化
图3、图4对比展示了不同复配比例下复合菌剂和单菌株在初始N![]() -N浓度为50mg·L-1的培养基中对N
-N浓度为50mg·L-1的培养基中对N![]() -N、TN的去除效果,结果表明,菌株在不同复配比例下脱氮效果存在显著差异。当W30与Z66的复配比例为3∶2时,培养至12h时,N
-N、TN的去除效果,结果表明,菌株在不同复配比例下脱氮效果存在显著差异。当W30与Z66的复配比例为3∶2时,培养至12h时,N![]() -N的脱除速率最大,此时的N
-N的脱除速率最大,此时的N![]() -N去除率为96.7%,当菌株培养至48h时,在复配比例W30∶Z66为5∶0、0∶5、4∶1、1∶4、3∶2、2∶3和1∶1时,复合菌剂N
-N去除率为96.7%,当菌株培养至48h时,在复配比例W30∶Z66为5∶0、0∶5、4∶1、1∶4、3∶2、2∶3和1∶1时,复合菌剂N![]() -N的去除率分别为30.6%、98.4%、98.9%、99.4%、99.9%、99.3%、99.8%,试验证明复合菌剂的N
-N的去除率分别为30.6%、98.4%、98.9%、99.4%、99.9%、99.3%、99.8%,试验证明复合菌剂的N![]() -N还原性能整体优于单一菌株的作用,复合菌剂的构建有效提高了硝酸盐氮的去除率。不同复配比例对TN脱除的变化规律与N
-N还原性能整体优于单一菌株的作用,复合菌剂的构建有效提高了硝酸盐氮的去除率。不同复配比例对TN脱除的变化规律与N![]() -N相似,复合菌剂的脱氮效果整体强于单一菌株,当W30、Z66两菌株以3:2为复配比例时在24h的脱氮效果最佳,TN去除率为51.5%,TN的脱除效率较N
-N相似,复合菌剂的脱氮效果整体强于单一菌株,当W30、Z66两菌株以3:2为复配比例时在24h的脱氮效果最佳,TN去除率为51.5%,TN的脱除效率较N![]() -N的脱除相对滞后,主要是因为N
-N的脱除相对滞后,主要是因为N![]() -N的还原速率快于N
-N的还原速率快于N![]() -N的还原速率,因此还原过程中会有短暂的N
-N的还原速率,因此还原过程中会有短暂的N![]() -N积累,导致培养基中TN浓度并没有快速下降。综上所述,优化得到有氧反硝化复合菌剂的最佳复合比例为W30∶Z66=3∶2。
-N积累,导致培养基中TN浓度并没有快速下降。综上所述,优化得到有氧反硝化复合菌剂的最佳复合比例为W30∶Z66=3∶2。

图2 W30和Z66 16S rDNA系统发育分析
Fig.2 Phylogenetic analysis of 16S rDNA for W30 and Z66
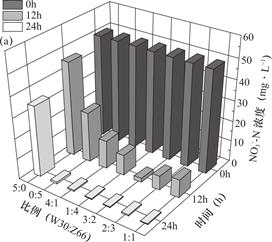
图3 不同复配比例下复合菌剂与单菌对N![]() -N的去除效果
-N的去除效果
Fig.3 Removal effect of compound agent and single bacterium on N![]() -N under different compound proportion
-N under different compound proportion
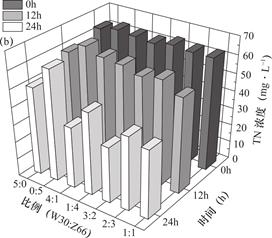
图4 不同复配比例下复合菌剂与单菌对TN的去除效果
Fig.4 TN removal effect of complex agent and single bacteria under different combination proportion
2.3 反硝化生物滤池启动阶段运行情况
如图5表明,在挂膜启动阶段COD的出水浓度在12~75mg·L-1之间变化,平均去除率为91.2%,在菌剂接种的第1天,COD的去除率便可达到82.3%,挂膜初期获得较好的有机物去除效果主要是由于在初始阶段微生物的活性和生物量较大,同时由于填料的截留作用,生物陶粒空隙中有大量生物聚集,且反硝化生物滤池进水中含有一定量的氧气(3.9~6.4mg·L-1),随着进水过程将氧气带入反硝化生物滤池系统内部,从而使系统内部形成低氧或者微氧环境,这有利于好氧菌的生长[15]。如图6所示,挂膜阶段TN的平均去除率在22.9%~80.0%范围内波动,最终稳定在70%以上;在启动时间方面,菌剂挂膜方式在第11天TN去除率稳定在70%以上,人工菌剂挂膜的COD去除率在第9天稳定在90%以上,综合考虑,该系统第11天即可完成挂膜启动。
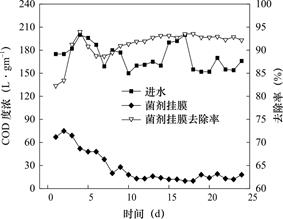
图5 挂膜启动阶段反硝化生物滤池COD的去除效果
Fig.5 COD removal effect of denitrifying biofilter at the start-up stage of membrane hanging
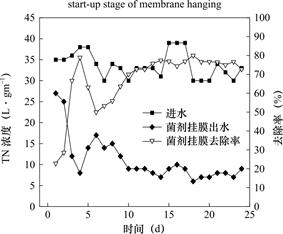
图6 挂膜启动阶段反硝化生物滤池TN的去除效果
Fig.6 TN removal effect of denitrifying biofilter at membrane start-up stage
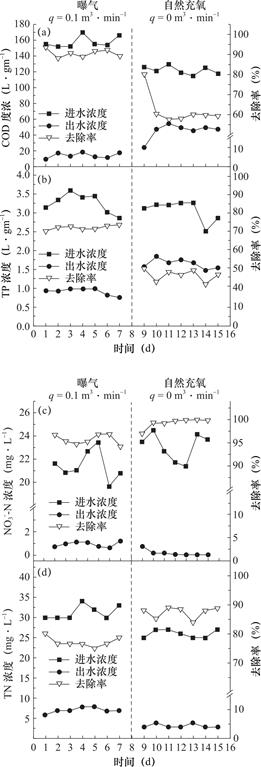
图7 不同曝气速率下生物滤池COD(a)、TP(b)、N![]() -N(c)、TN(d)的去除效果
-N(c)、TN(d)的去除效果
Fig.7 Removal effects of COD(a)、TP(b)、N![]() -N(c) and TN(d) in biofilters at different aeration rates
-N(c) and TN(d) in biofilters at different aeration rates
2.4 曝气条件对生物滤池的影响
对比曝气(曝气速率q=0.1m3·min-1)和自然充氧(曝气速率q=0m3·min-1)两种不同曝气条件下反硝化生物滤池对污染物的去除效果,如图7(a)所示,两种曝气条件下COD平均去除率分别为90.6%和62.2%,自然充氧条件下COD的去除率较曝气条件下的下降了28.4%,这一定程度上节省了碳源,为碳源优化提供了空间。图7(b)所示,进水TP浓度在2.50~3.58mg·L-1范围内,其中自然充氧条件下出水平均浓度为1.57mg·L-1,曝气条件下平均浓度为0.71mg·L-1。如图7(c)所示,自然充氧条件下N![]() -N平均去除率为99.3%,曝气条件下N
-N平均去除率为99.3%,曝气条件下N![]() -N平均去除率为95.7%,两种曝气条件下反硝化生物滤池均呈现出对N
-N平均去除率为95.7%,两种曝气条件下反硝化生物滤池均呈现出对N![]() -N较好的去除效果。
-N较好的去除效果。
如图7(d)所示,不同曝气条件下生物反应器均表现出良好的脱氮效果,曝气条件下出水TN平均浓度为6.0mg·L-1,自然充氧条件下出水平均浓度为3.29mg·L-1,自然充氧条件下TN的去除率较曝气条件下提高了9.36%。
2.5 水力停留时间对生物滤池的影响
水力停留时间(HRT)是影响污水处理效果的主要因素之一。HRT过小,污水未能与填料表面生物膜充分接触便流出反应装置,降低了反应装置对目标污染物的去除效果;当HRT达到一定的值时,已足够各反应器内反应的充分进行,再增加HRT,不仅会造成资源的浪费且对脱氮效果不再有显著的提升。生物滤池在不同HRT运行条件下的COD、TN、N![]() -N、N
-N、N![]() -N的去除效果如图8所示。
-N的去除效果如图8所示。
当HRT由0.5 h提高至2.5 h的过程中,COD的平均去除率总体呈现出先上升后下降的变化趋势,HRT在0.5h~1h变化范围内 COD的平均去除率约为76%,1.6h与2h去除率降低到约66%,系统COD的平均出水浓度分别25.57mg·L-1、24.00mg·L-1、25.71mg·L-1、36.00mg·L-1和35.14mg·L-1;相应的,TN的平均去除率分别为55.8%、60.7%、71.3%、75.5%和79.9%,随着水力停留时间的增大而增大,而反应装置系统出水N![]() -N浓度变化幅度较小,N
-N浓度变化幅度较小,N![]() -N的平均去除率均达到99%以上;对应的,滤池出水N
-N的平均去除率均达到99%以上;对应的,滤池出水N![]() -N的浓度分别为7.34mg·L-1、6.15mg·L-1、2.51mg·L-1、1.64mg·L-1和0.04mg·L-1,呈现出随着HRT的增大逐步下降的变化趋势。综合考虑,确定该系统HRT=1.0h时为最优的水力停留时间。
-N的浓度分别为7.34mg·L-1、6.15mg·L-1、2.51mg·L-1、1.64mg·L-1和0.04mg·L-1,呈现出随着HRT的增大逐步下降的变化趋势。综合考虑,确定该系统HRT=1.0h时为最优的水力停留时间。
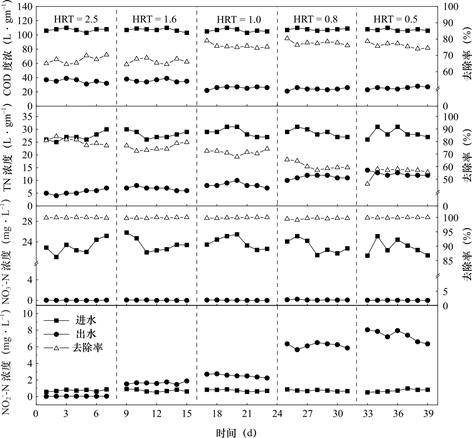
图8 不同HRT下生物滤池COD、TN、N![]() -N、N
-N、N![]() -N的去除效果
-N的去除效果
Fig.8 Removal effects of COD,TN,N![]() -N and N
-N and N![]() -N in biofilters under different HRT conditions
-N in biofilters under different HRT conditions
2.6 碳氮比对生物滤池的影响
二级出水中底物浓度较低且可生化性较差,需额外投加碳源,而碳源投加量是影响反硝化效果的重要因素[16,17]。如图9所示,当C/N按试验设定梯度由2.23提升至4.64时,出水COD浓度整体随着C/N的提高而升高,平均去除率分别为67.3%、62.2%、71.2%、69.1%、72.9%和68.5%。
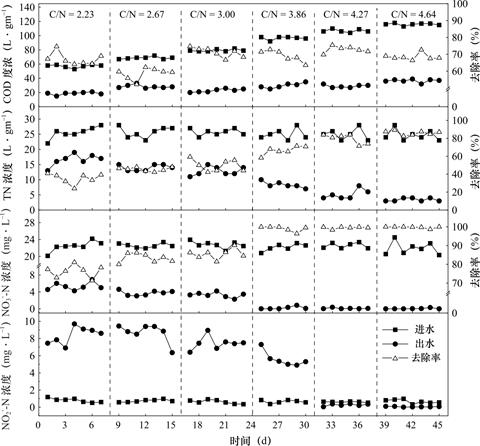
图9 不同C/N下生物滤池COD、TN、N![]() -N、N
-N、N![]() -N的去除效果
-N的去除效果
Fig.9 Removal effects of COD,TN,N![]() -N and N
-N and N![]() -N in biofilter under different C/N conditions
-N in biofilter under different C/N conditions
当C/N≤3.00时,TN的平均脱除率≤50%,反映出此时的碳源投加量未能满足生物滤池反硝化脱氮的需求,导致脱氮效率较低;当C/N>4.27时,继续增大碳氮比,滤池对TN的脱除效率不再显著提升;当C/N=3.86时,N![]() -N的平均去除率达到99%以上;随着碳氮比的进一步提升,当C/N>3.86时,N
-N的平均去除率达到99%以上;随着碳氮比的进一步提升,当C/N>3.86时,N![]() -N的平均去除率均在99%以上,但增幅有所减缓,说明此时碳源投加过量,在运行条件一定的情况下,碳氮比不再是限制反应器内脱氮的唯一因素。与此同时,虽然当C/N=3.86时,反应器对N
-N的平均去除率均在99%以上,但增幅有所减缓,说明此时碳源投加过量,在运行条件一定的情况下,碳氮比不再是限制反应器内脱氮的唯一因素。与此同时,虽然当C/N=3.86时,反应器对N![]() -N去除效率较高,但是仍出现了5.58mg·L-1的N
-N去除效率较高,但是仍出现了5.58mg·L-1的N![]() -N积累,证明此时碳源投加量仍然不足,反硝化反应不能彻底进行,只能将N
-N积累,证明此时碳源投加量仍然不足,反硝化反应不能彻底进行,只能将N![]() -N还原成N
-N还原成N![]() -N,导致一定的N
-N,导致一定的N![]() -N积累未能充分还原;综上所述,综合脱氮效果及碳源投加的经济成本,最终确定该系统进水C/N=4.27时为最优的碳氮比运行条件。
-N积累未能充分还原;综上所述,综合脱氮效果及碳源投加的经济成本,最终确定该系统进水C/N=4.27时为最优的碳氮比运行条件。
2.7 细菌微生物群落特征分析
结合反硝化生物滤池的去除效果,选取不同时期生物滤池填料表面生物膜样本进行高通量测序分析,不同时期菌剂强化反硝化生物滤池中微生物群落分析表征Alpha多样性的分析指数如表2所示。随着系统的运行,物种丰富度及多样性呈现出逐渐下降的变化趋势。对比A、B、C、D四个时期Alpha多样性的分析指数可知A样本的Shannon、Ace、Chao值均为四个时期中的最大值,说明菌剂强化初期物种丰富度大,群落结构更复杂,样本D物种多样性最低。同样的,Simpson指数结果保持一致,证明其物种丰富度随生物滤池的运行而降低。其微生物多样性有所下降主要是因为生物滤池的驯化条件的变化使其淘汰了一些菌种,促进其优势菌种的生长。其次,所有样品的Coverge指数均超过99%,说明本次测序中A、B、C、D四个样本序列中未被测出的概率均较低,可信度高,所获得的序列能够较好地描述样本中微生物群落的真实情况。
如图10所示,随着反应器运行时间的变化,系统内的优势菌门也有所不同。对比A、B、C、D四个样本的物种组成发现6个门水平的细菌(相对丰度>0.01%),分别为Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)、Bacteroidota(拟杆菌门)、Actinobacteriota(放线菌门)、Desulfobacterota(脱硫菌门)、Patescibacteria(髌骨细菌门)。不同样本中门水平上的优势物种有所不同,在样本A、C、D 中的Proteobacteria占比最高,占比分别为46%、77%、79%;而B样本中的优势菌门为Firmicutes,占比71%,Proteobacteria占比14.73% 为第二丰度菌门,Firmicutes在A、C、D样本中的占比分别为30.38%、2.78%、5.37%。因此Proteobacteria和Firmicutes是该滤池系统内的主要优势菌门,参与菌剂强化的生物滤池在尾水深度处理过程中的反硝化脱氮。变形菌门常常被认为是优势脱氮菌门,且这一门广泛分布于废水和污泥中[18,19]。
表2 不同时段下反硝化生物滤池微生物多样性分析
Table 2 Microbial diversity analysis of denitrifying biofilterat different time periods
|
样品 |
Shannon |
Simpson |
Ace |
Chao |
Coverage |
|
A |
3.9219 |
0.0480 |
775.2625 |
747.2800 |
0.9971 |
|
B |
3.7859 |
0.0484 |
746.1580 |
744.2500 |
0.9969 |
|
C |
2.8421 |
0.2334 |
716.1267 |
736.3971 |
0.9970 |
|
D |
2.6499 |
0.2516 |
716.8648 |
689.9432 |
0.9970 |
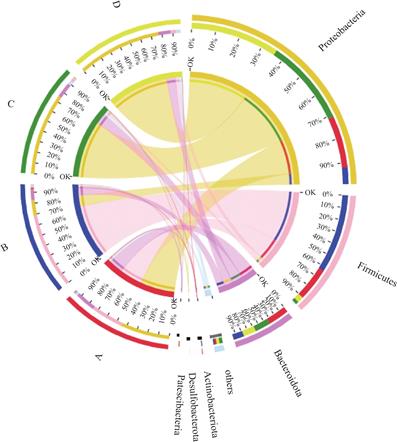
图10 反硝化生物滤池不同时段门水平上样本与物种的共线性关系
Fig.10 Colinear relationship between samples and species at gate level in different stages of a denitrifying biofilter
如图11所示,滤池系统中的Thauera(陶厄氏菌属)和其他菌的占比较高,其中Thauera、Simplicispira(贪食菌属)[20]、Pseudomonas(假单胞菌属)[21]、Bacillus(芽孢杆菌属)[22]、Acinetobacter(不动杆菌属)[23]、Flavobacterium(黄杆菌属)和Hydrogenophaga(氢噬胞菌属)[24]主要在系统的反硝化过程中发挥作用;其中变形菌门中的Thauera属不光参与系统的反硝化脱氮,更对COD具有良好的去除效果;同时Macellibacteroides(发酵菌属)具有水解和消化大分子物质的能力[25],黄杆菌属和氢噬胞菌属对结构复杂的有机物具有较强的降解作用[26,27],除此之外,系统内富集了一定丰度的Dechlorobacter(去氯杆菌属)、Flavobacterium和unclassified_f_Comamonadacea等菌属,有研究表明这些菌属在乙酸钠碳源系统更容易富集,同时这些菌属与EPS的产生有关[28]。
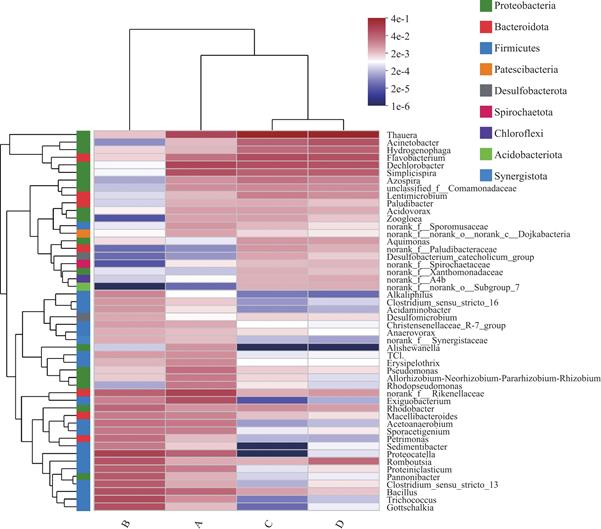
图11 不同时段生物滤池属水平上物种丰度聚类图
Fig.11 Cluster diagram of species abundance at genus level in biofilters at different time periods
通过微生物群落结构属水平上的分析,更好地解释了菌剂强化的反硝化生物滤池在不同种群的协同作用下对氮素及有机物的有效去除。对于投加的复合菌剂中的Pannonibacter菌属和Pseudomonas菌属在反硝化生物滤池中的所占比例由初期的0.49%和2.56%直至反应装置运行至130天时的0.073%和0.18%,物种丰度明显下降,四个样本中的所占比例分别为和0.49%和2.56%、5.49%和0.28%、0.044%和0.26%、0.073%和0.18%,反应器运行后期Pseudomonas的丰度大于Pannonibacter,投加的复合菌剂在反硝化生物滤池运行后期整体丰度较低,但与Thauera、Dechlorobacter、Exiguobacterium等菌属形成稳定的脱氮系统,通过协同作用在反应装置中稳定高效地发挥着脱氮作用。
3 结论
(1)课题组前期筛选得到的两株有氧反硝化菌株经16S rDNA鉴定和NCBI序列比对,结果证明W30为Pannonibacter属,并命名为Pannonibacter sp.W30,Z66为Pseudomonas属,并命名为Pseudomonas sp.Z66。
(2)复合有氧反硝化菌株相较于单一菌株具有较好的脱氮效果及较快的脱氮速率。结果表明,W30、Z66两菌株以3∶2为复配比例时脱氮效果最佳。
(3)经复合菌剂接种的反硝化生物滤池经11天便可挂膜成功,滤池系统在自然充氧条件下脱氮效果显著提升,自然充氧条件下TN的去除率较曝气条件下提高了9.36%;在碳氮比及水力停留时间单因素试验中确定C/N=4.27,HRT=1.0h为滤池的最优工况。
(4)分析滤池系统微生物群落结构可知,随着滤池的运行同一高度下填料表面的物种丰富度逐渐下降且物种分布均匀。Proteobacteria(变形菌门)和Firmicutes(厚壁菌门)为复合菌剂强化反硝化生物滤池中的优势菌门;Pannonibacter和Pseudomonas两菌属在反硝化生物滤池中的所占比例由初期的0.49%和2.56%直至反应装置运行至130天时的0.073%和0.18%,物种丰度明显下降,但与Thauera、Dechlorobacter、Exiguobacterium等菌属形成稳定的脱氮系统,在反应装置中稳定高效的发挥着脱氮作用,综合考虑菌剂投加的周期为2~4个月,以保证菌剂强化的反硝化生物滤池长期稳定运行且投加菌剂在系统内保持一定丰度。
利益冲突: 作者声明无利益冲突。
[①] *通讯作者 Corresponding author:闫高俊,2365222673@qq.com
收稿日期:2021-12-14; 录用日期:2023-03-07; 发表日期:2023-06-28
基金项目:教育部“产学合作协同育人”项目(BINTECH-KJZX-20220831-05);内蒙古自治区交通运输科技项目(NJ-2021-19);国家水体污染控制与治理科技重大专项(2018ZX07110)
参考文献(References)
[1] CHENG Y F, LI G F, LIU Y Y, et al. Evaluating theeffects of Zn(II)on high-rate biogranule-based denitri-fication: Performance, microbial community and sludge characteristics[J]. Bioresource Technology, 2019, 279: 393-397.
https://doi.org/10.1016/j.biortech.2019.02.005
[2] GLASS C, SILVERSTEIN J. Denitrification of high-nitrate, high-salinity wastewater[J]. Water Research, 1999, 33(1): 223-229.
https://doi.org/10.1016/S0043-1354(98)00177-8
[3] 李磊, 周克梅, 王君娴, 等. 水力负荷对生物滞留池处理污水厂尾水的影响[J]. 中国给水排水, 2018, 34(23): 115-118.
https://dx.doi.org/10.19853/j.zgjsps.1000-4602.2018.23.023
[4] ROBERTSON L A, KUENEN J G. Thiosphaera pantotropha gen. nov. sp. nov. , a facultatively anaerobic, facultatively autotrophic sulphur bacterium[J]. Microbiology, 1983, 129(9): 2847-2855.
https://doi.org/10.1099/00221287-129-9-2847
[5] YANG L, WANG X H, CUI S, et al. Simultaneous removal of nitrogen and phosphorous by heterotrophic-nitrificationaerobic denitrification of a metal resistant bacterium Pseudomonas putida strain NP5[J]. Biore-Source Technology, 2019, 285: 121360.
https://doi.org/10.1016/j.biortech.2019.121360
[6] ZHANG Q L, LIU Y, AI G M, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresource Technology, 2012, 108: 35-44.
https://doi.org/10.1016/j.biortech.2011.12.139
[7] LU Z, GAN L, LIN J, et al. Aerobic denitrification by Paracoccus sp. YF1 in the presence of Cu(II)[J]. Science of the Total Environment, 2019, 658: 80-86.
https://doi.org/10.1016/j.scitotenv.2018.12.225
[8] LIU Y, WANG Y, LI Y, et al. Nitrogen removal characteristics of heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis C16[J]. Chinese Journal of Chemical Engineering, 2015, 23(5): 827-834.
https://doi.org/10.1016/j.cjche.2014.04.005
[9] HUANG F, PAN L, HE Z, et al. Culturable heterotrophic nitrification-aerobic denitrification bacterial consortia with cooperative interactions for removing ammonia and nitrite nitrogen in mariculture effluents[J]. Aquaculture, 2020, 523: 735211.
https://doi.org/10.1016/j.aquaculture.2020.735211
[10] LIU C, XIE J, SONG M, et al. Nitrogen removal per- formance and microbial community changes in subsurface wastewater infiltration systems(SWISs)at low temperature with different bioaugmentation strategies[J]. Bioresource Technology, 2018, 250: 603-610.
https://doi.org/10.1016/j.biortech.2017.11.089
[11] 陈均利, 彭英湘, 罗沛, 等. 异养硝化-好氧反硝化菌的脱氮特性及其对猪场废水处理的研究[J]. 环境污染与防治, 2021, 43(03): 295-299, 303.
https://dx.doi.org/10.15985/j.cnki.1001-3865.2021.03.005
[12] 吴丽红, 李晓惠, 杨芳, 等. 蜡状芽孢杆菌生物强化反硝化脱氮研究[J]. 中国给水排水, 2016, 32(03): 89- 92, 96.
https://dx.doi.org/10.19853/j.zgjsps.1000-4602.2016.03.020
[13] 国家环保局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 第四版. 北京: 中国环境科学出版社, 2003: 201-271.
[14] Zhang N, Zhang Y, Bohu T, et al. Nitrogen Removal- Characteristics and Constraints of an Alphaproteobacteria with Potential for High Nitrogen Content Heterotrophic Nitrification-Aerobic Denitrification[J]. Microorganisms, 2022, 10(2): 235.
https://doi.org/10.3390/microorganisms10020235
[15] 王林, 张浩浩, 吴兴海, 等. 反硝化生物滤池深度脱氮中试运行效能及微生物菌群分析[J]. 同济大学学报(自然科学版), 2021, 49(12): 1727-1737.
https://dx.doi.org/10.11908/j.issn.0253-374x.21310
[16] 郑晓英, 乔露露, 王慰, 等. 碳源对反硝化生物滤池运行及微生物种群的影响[J]. 环境工程学报, 2018, 12(05): 1434-1442.
https://dx.doi.org/10.12030/j.cjee.201710046
[17] 张玲玲, 杨永强, 张权, 等. 组合型人工湿地对二级好氧单元出水的深度处理[J]. 环境工程学报, 2019, 13(07): 1592-1601.
https://dx.doi.org/10.12030/j.cjee.201811083
[18] GAO P, XU W, SONTAG P, et al. Correlating microbial community compositions with environmental factors in activated sludge from four full-scale municipal wastewater treatment plants in Shanghai[J], China Applied Microbiology and Biotechnology, 2016, 100(10): 4663-4673.
https://doi.org/10.1007/s00253-016-7307-0
[19] SUN H, WU Q, YU P, et al. Denitrification using excess activated sludge as carbon source: performance and the microbial community dynamics[J]. Bioresource Technology, 2017, 238: 624-632.
https://doi.org/10.1016/j.biortech.2017.04.105
[20] PENG C, GAO Y, FAN X, et al. Enhanced biofilm formation and denitrification in biofilters for advanced nitrogen removal by rhamnolipid addition[J]. Bioresource technology, 2019, 287: 121387.
https://doi.org/10.1016/j.biortech.2019.121387
[21] SAHINKAYA E, KILIC A, CALIMLIOGLU B, et al. Simultaneous bioreduction of nitrate and chromate using sulfur-based mixotrophic denitrification process[J]. Journal of hazardous materials, 2013, 262: 234-239.
https://doi.org/10.1016/j.jhazmat.2013.08.050
[22] SUN Y, DE VOS P, HEYLEN K. Nitrous oxide emission by the non-denitrifying, nitrate ammonifier Bacillus licheniformis[J]. Bmc Genomics, 2016, 17(1): 1-11.
https://doi.org/10.1186/s12864-016-2382-2
[23] NAN Q, WANG C, WANG H, et al. Biochar drivesmicrobially- mediated rice production by increasing soil carbon[J]. Journal of hazardous materials, 2020, 387: 121680.
https://doi.org/10.1016/j.jhazmat.2019.121680
[24] CHAKRAVARTHY S S, PANDE S, KAPOOR A, et al. Comparison of denitrification between Paracoccus sp. and Diaphorobacter sp. [J]. Applied biochemistry and biotechnology, 2011, 165(1): 260-269.
https://doi.org/10.1007/s12010-011-9248-5
[25] ZHANG B, XU X, ZHU L. Structure and function of the microbial consortia of activated sludge in typical municipal wastewater treatment plants in winter[J]. Scientific reports, 2017, 7(1): 1-11.
https://doi.org/10.1038/s41598-017-17743-x
[26] XING W, LI J, LI P, et al. Effects of residual organics in municipal wastewater on hydrogenotrophic denitrifying microbial communities[J]. Journal of Environmental Sciences, 2018, 65: 262-270.
https://doi.org/10.1016/j.jes.2017.03.001
[27] HUR J, LEE B M, CHOI K S, et al. Tracking the spectroscopic and chromatographic changes of algal derived organic matter in a microbial fuel cell[J]. Environmental Science and Pollution Research, 2014, 21(3): 2230-2239.
https://doi.org/10.1007/s11356-013-2125-8
[28] LIU H, ZHU L, TIAN X, et al. Seasonal variation ofbacterial community in biological aerated filter for ammonia removal in drinking water treatment[J]. Water Research, 2017, 123: 668-677.
https://doi.org/10.1016/j.watres.2017.07.018
Deep Treatment of Tailwater by Aerobic Denitrifying Bacteria Enhanced Biofilter
(1. Institute of Advanced Technology, Binzhou Weiqiao Guoke, Binzhou 256600, China
2. College of Environmental Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050000, China
3. Inner Mongolia High-speed Technology Industry Co. LTD, Hohhot 010052, China
4. Sino-Danish College, University of Chinese Academy of Sciences, Beijing 100049, China
5. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049, China)
Abstract: The high concentration of total nitrogen in the tailwater discharged from some wastewater treatment plants is relatively high, which is easy to cause eutrophication in the receiving water bodies. In this study, the aerobic denitrifying bacteria were combined with denitrifying biofilter through bioreinforcement technology. The aerobic denitrifying bacteria strains W30 and Z66 isolated from activated sludge were used to construct a complex bacterial agent to strengthen the denitrifying biofilter, and the enhanced nitrogen removal effect of the complex bacterial agent was investigated, and the microbial community structure in the system after bioreinforcement was analyzed by high-throughput sequencing technology. The results showed that strain W30 was identified as Pannonibacter and strain Z66 as Pseudomonas by 16S rDNA sequencing analysis. The bioreinforced denitrification biofilter had a fast start-up rate of membrane hanging, and the removal rate of total nitrogen (TN) increased by 9. 36% under natural oxygenation compared with that under aeration; the single-factor test of carbon/nitrogen ratio (C/N) and hydraulic retention time (HRT) determined C/N=4. 27 and HRT=1. 0 h as the optimal working conditions of the filter cell; the highthroughput sequencing results further showed that the percentages of Pannonibacter and Pseudomonas in the denitrifying biofilter decreased from 0. 49% and 2. 56% at the beginning of operation to 0. 073% and 0. 18% after 130 days of operation. A stable denitrification system was formed with Thauera, Dechlorobacter, Exiguobacterium and other genera.
Keywords: Aerobic denitrifying bacteria, complex bacterial agent, denitrifying biofilters, deep tailwater treatment, microbial diversity
DOI: 10.48014/cesr.20221209001
Citation: ZHANG Yiting, ZHANG Nan, YAN Gaojun, et al. Deep treatment of tailwater by aerobic denitrifying bacteria enhanced biofilter[J]. Progress in Chinese Eco-Environmental Protection, 2023, 1(2): 10-21.