

聚多巴胺涂层修饰海藻酸钙/聚丙烯酰胺防粘连水凝胶的制备及性能
(1. 大连理工大学 材料科学与工程学院, 大连 116024
2. 首都医科大学附属北京友谊医院, 北京 100050)
摘要: 预防宫腔粘连 (IUA) 术后再粘连主要采用薄膜和水凝胶材料作为防粘连屏障, 但目前临床上使用的材料由于粘附性不足及降解太快等问题, 疗效仍不理想。海藻酸钙/聚丙烯酰胺 (CA/PAM) 双网络水凝胶力学性能及生物相容性优异, 适宜作为防粘连材料, 但粘附性不足, 易发生移位。本文采用聚多巴胺 (PDA) 涂层修饰CA/PAM水凝胶, 制备得到PDA@CA/PAM水凝胶, 以改善其粘附性。SEM图像表明PDA涂层成功涂覆, 并且水凝胶具有良好的三维多孔网络结构。力学性能测试显示水凝胶具有优异的拉伸及压缩性能, 使其可顺利进入目标位置并且承受一定的压力; 搭接-剪切实验证明, PDA涂层的修饰使CA/PAM水凝胶的组织粘附性能明显提升; 溶胀及降解性能表明该水凝胶可以吸收创面渗液并且在创面保持一定的时间。PDA涂层的引入也使得水凝胶的亲水性有所提升。细胞毒性测试及溶血实验显示, 水凝胶的细胞活性均在80%以上, 溶血率均在5%以下。并且PDA@CA/PAM水凝胶显示出比CA/PAM更高的细胞相容性和血液相容性。
关键词: 防粘连, 水凝胶, 聚多巴胺, 海藻酸钠, 聚丙烯酰胺
DOI: 10.48014/pcms.2022120202002
引用格式: 薛贝贝, 王兆元, 董旭峰. 聚多巴胺涂层修饰海藻酸钙/聚丙烯酰胺防粘连水凝胶的制备及性能[J]. 中国材料科学进展, 2022, 1(3): 45-56.
文章类型: 研究性论文
收稿日期: 2022-12-02
接收日期: 2022-12-12
出版日期: 2022-12-28
0 引言
宫腔粘连(intrauterine adhesion,IUA),又称为Asherman综合征,是一种常见的妇科疾病[1,2]。它是由于多次反复的人工流产、刮宫产或感染等因素对子宫内膜基底层造成损伤,从而引起纤维组织增生,导致子宫腔部分或完全闭塞的一种疾病,IUA已成为女性继发性不孕的第二大病因[3-5]。目前治疗宫腔粘连的金标准是宫腔镜下的粘连松解术(transcervical resection of adhesions,TCRA),可以对粘连组织进行精准的分离[6]。但TCRA术后宫腔粘连的复发率很高,在中重度患者中达到21.6%~62.5%[7],因而如何有效预防TCRA术后再粘连是宫腔粘连治疗中的一个重大挑战。
目前临床上经常使用宫内节育器(intrauterine device,IUD)、宫内球囊等物理屏障单独使用或者联合药物使用来预防TCRA术后再粘连,但治疗效果均有限[8]。临床医生也在TCRA术后应用了透明质酸(HA)水凝胶以及INTERCEED(一种由氧化再生纤维素制成的可吸收抗粘连屏障)等生物材料来防止术后再粘连[9]。但HA水凝胶在体内快速降解,一般一周左右就会消失,发挥作用的时间较短,而且HA的力学性能较差[10,11]。INTERCEED是FDA批准的第一种商用抗粘连膜,它是一种机械式的抗粘连屏障,可以显著减少术后粘连,并且在2周内降解完全。但是它的粘附性能较差,放置在组织上的材料会发生位移[12,13]。
随着干细胞和再生医学的发展,各种天然及合成的新型生物材料被应用到IUA的预防和治疗中。生物材料除了具有物理屏障的作用外,还可以搭载激素类药物、干细胞及其衍生物。其中水凝胶是最有潜力的运输载体,水凝胶是一种由大分子亲水性聚合物的化学或物理交联形成的三维多孔网络结构[14,15],这与细胞外基质的特征相似[16]。而且水凝胶具有可调整的化学和物理性能[17,18],来匹配接触的组织。水凝胶也因为独特的三维网络结构,可以封装各种治疗成分成为治疗输送系统,来有效地预防术后再粘连并且促进子宫内膜再生。理想的宫腔防粘连水凝胶应具有良好的生物相容性、降解性、力学性能、组织粘附性能及拥有负载药物的空间。但目前水凝胶在该领域缺乏充分的研究,合适的水凝胶尚未开发出来预防术后再粘连。
2012年,锁志刚等[19]结合钙离子交联的海藻酸盐和聚丙烯酰胺两种单网络突破了以往水凝胶力学性能差的缺点,开发出具备优异力学性能的双网络水凝胶,并且这种双网络水凝胶近几年也得到了广泛的研究。但是,目前使用的主要是N,N-亚甲基双丙烯酰胺(MBA)这种毒性大且不可降解的交联剂。近几年又有文献报道使用N,N'-双(丙烯酰基)胱胺(BAC)作为聚丙烯酰胺的交联剂,来得到可降解,具备优异力学性能及生物相容性的海藻酸钙/聚丙烯酰胺双网络水凝胶[20,21],但是该双网络水凝胶具有相对较弱的组织粘附性。
聚多巴胺(PDA)是一种贻贝仿生类材料,可由多巴胺(DA)在弱碱性环境下氧化自聚而得,PDA结构中有大量邻苯二酚基团,使得其可以吸附在几乎所有固体物质的表面,形成一层PDA膜[22]。自从2007年报道了利用多巴胺实现了多种材料的表面改性后[22],因为PDA的强粘附性,良好的生物相容性、降解、止血和适度的抗菌性能等[23,24],利用PDA进行表面改性一时得到了广泛的研究[25-28]。因此,本文对制备的海藻酸钙/聚丙烯酰胺(CA/PAM)双网络水凝胶进行PDA表面改性,以增强其组织粘附性和生物性能,使这种水凝胶适合用于宫腔防粘连。文中对PDA@CA/PAM水凝胶的形貌结构、力学性能、组织粘附性能、亲水性、溶胀和体外降解性能进行表征与测试,并进行了细胞毒性测试及溶血实验。通过与CA/PAM水凝胶进行对比,系统地研究和分析了PDA涂层对水凝胶性能的影响。
1 实验部分
1.1 材料
丙烯酰胺(AM)、N,N'-双(丙烯酰基)胱胺(BAC)、过硫酸铵(APS)、无水氯化钙(CaCl2)、海藻酸钠(SA)、N、N,N-',N-四甲基乙二胺(TEMED)、盐酸多巴胺(DA)、L-半胱氨酸、三羟甲基氨基甲烷(Tris)、磷酸盐缓冲盐水(PBS)、小鼠胚胎成纤维细胞(NIH/3T3)、CCK-8试剂盒、胎牛血清(FBS)、DMEM培养基、青霉素–链霉素混合溶液(双抗)、山羊血。
1.2 CA/PAM水凝胶的制备
通过两步法制备CA/PAM水凝胶。将3.60g AM、0.0132g BAC交联剂和0.6g SA溶解在30mL去离子水中,将混合物在磁力搅拌器上冰浴搅拌过夜。搅拌均匀后在混合溶液中添加一定量的APS引发剂和TEMED催化剂冰浴搅拌均匀,将烧杯中的水凝胶前体溶液倒入玻璃培养皿中静置24h得到海藻酸钠/聚丙烯酰胺(SA/PAM)水凝胶,然后将SA/PAM水凝胶浸泡在CaCl2溶液中6h进行离子交换,最后得到海藻酸钙/聚丙烯酰胺(CA/PAM)水凝胶。
1.3 PDA@CA/PAM水凝胶的制备
Tris-HCl缓冲液的配制:在800mL去离子水中溶解1.21g Tris,待溶解完全后,用HCl将溶液pH调至8.5。之后用容量瓶定容至1000mL,最终得到浓度为10mmol/L pH=8.5的Tris-HCl缓冲液。
称量一定质量的DA加入到上述配制好的Tris-HCl缓冲液中,使多巴胺浓度为10mg/mL。将上述制备得到的CA/PAM水凝胶浸泡在DA的Tris-HCl缓冲液(pH=8.5)中,通过磁力搅拌器搅拌反应24h,得到PDA涂层修饰的CA/PAM(PDA@CA/PAM)水凝胶。
1.4 形貌和结构表征
CA/PAM和PDA@CA/PAM水凝胶的形态和结构,使用IT800-SHL高分辨场发射扫描电子显微镜(日本电子)和Nicolet iS20高级傅里叶变换红外光谱仪(赛默飞,美国)表征分析。
1.5 力学性能测试
通过HY-0580电子万能试验机(上海衡翼精密仪器有限公司)对CA/PAM及PDA@CA/PAM水凝胶进行拉伸测试。10N传感器用于拉伸测试,用于拉伸测试的水凝胶用裁刀切成哑铃状,测试样品工作长度为10mm,宽度为2mm,拉伸速度为30mm/min。
通过KY-5KNW电子万能试验机(上海凯宴检测仪器有限公司)对PDA@CA/PAM水凝胶进行循环压缩测试。200N传感器用于循环压缩测试,用于循环压缩实验的水凝胶用ϕ13裁刀切成圆柱状,压缩样品直径13mm,高度8mm。压缩速率为50mm/min,压缩至其应变的75%,然后以相同的速率去除载荷直至应变为0,反复压缩5次,来测试其抗压性能。
通过MCR301旋转流变仪(奥地利AntonPaar公司)对水凝胶的黏弹性进行测试。测试所用的水凝胶直径13mm,厚度3mm。测试记录水凝胶的剪切模量随应变振幅的变化曲线。
1.6 粘附性能评估
使用猪皮模拟人体组织,通过搭接-剪切实验[29]测试水凝胶的组织粘附性能。如图1所示,将水凝胶裁成22mm×22mm的矩形,然后将其粘附在两片猪皮中间,最后将其粘附在两个相同的载玻片上,通过HY-0580电子万能试验机以5mm/min的速率拉伸载玻片,直至凝胶与猪皮分离,所有样品测试三次。

图1 使用猪皮做搭接-剪切实验的照片
Fig.1 Photograph of lap-shear experiment using pigskin
1.7 溶胀性能测试
测试之前,称量水凝胶的初始质量W0,然后将水凝胶浸泡在温度为37℃的PBS中,每隔一定的时间取出,用滤纸吸干表面的水分并进行称重,记为Wt。用溶胀比公式计算其溶胀率:
溶胀率(%)=![]() ×100(1)
×100(1)
1.8 体外降解能力测试
称取一定质量的水凝胶,初始质量记作W0,然后将水凝胶浸泡在PBS和20μm半胱氨酸的模拟体液中,并于37℃的恒温摇床中培养。定期取出并用水洗涤水凝胶样品,冷冻干燥48h后再次称重,记为Wd。水凝胶样品的体外降解能力由样品的质量损失百分比来评估,通过以下公式计算:
质量损失(%)=![]() ×100(2)
×100(2)
1.9 表面亲水性测试
通过DSA100接触角仪(克吕士,德国)对水凝胶表面的亲水性进行测试,测试前将样品表面烘干,每次在样品表面滴2μL去离子水,通过仪器自带录像设备记录液滴接触样品表面后的图像,并通过仪器自带软件测量接触角。
1.10 体外细胞相容性评估
细胞培养:本文中用于测试样品生物性能的细胞均采用小鼠胚胎成纤维细胞(NIH/3T3),通过向DMEM培养基中加入10%FBS和1%的双抗配制完全培养基,NIH/3T3细胞采用完全培养基进行培养,培养环境为37℃、5%的CO2。
细胞毒性测试:将冻干的水凝胶样品用紫外灭菌2h,用培养基浸泡24h,浸提浓度为1mg/mL。将100μL的NIH/3T3细胞悬液加入至96孔板中培养24h(1×104个/孔),用水凝胶浸提液替换旧的培养基,每孔100μL,对照组包含细胞和培养基,空白对照只加入等量的培养基,继续培养1d、2d、3d后,在每孔中加入10μL CCK-8检测液,培养箱继续培养4h。最后将此96孔板放入SpectraMax M2e全波长多功能微孔板测读仪(美谷分子,美国)中振荡,并在450nm处扫描光密度值(OD)。以下公式用于计算细胞活性:
细胞活性(%)=![]() ×100(3)
×100(3)
1.11 溶血实验
生理盐水(NS)稀释新鲜的山羊血,稀释比例为生理盐水10mL加入8mL全血。在15mL离心管中加入10mL生理盐水,随后将水凝胶样品用NS冲洗后浸入含有10mL NS的离心管中,该离心管先在37℃孵育30min,然后向离心管中加入0.2mL稀释后的血液,混合物在37℃孵育60min。NS作为阴性对照组,去离子水作为阳性对照组。此后,将所有离心管以3000r/min离心5min,收集上清液,并用540nm的微孔板测读仪记录光密度值(OD)。溶血率使用以下公式计算:
溶血率(%)=![]() ×100(4)
×100(4)
2 结果与讨论
2.1 形貌和结构表征
图2是CA/PAM和PDA@CA/PAM水凝胶样品的宏观图像,从图中可以看出在PDA改性后,水凝胶明显变成黑褐色,表明PDA成功吸附在水凝胶表面,形成了均匀的涂层。

图2 水凝胶的宏观图像
Fig.2 Macroscopic images of hydrogels
图3是水凝胶样品的FTIR谱图对比,可以看到在PDA@CA/PAM的1264cm-1处显示了一个新的峰,对应于PDA苯胺中C-N的拉伸振动,这个峰的存在说明PAM的-NH2基团和PDA的邻苯二酚基团间的相互作用。1510cm-1处和1350cm-1处的峰也是由于PDA的芳香环。在3390cm-1和3170cm-1处的峰分别来自羟基(O-H)和胺基(N-H)以及PDA芳环的C-H伸缩振动[30-33]。在PDA@CA/PAM水凝胶的FTIR谱图中成功检测到了PDA的谱带特征,这便证实了PDA@CA/PAM水凝胶中PDA的存在。
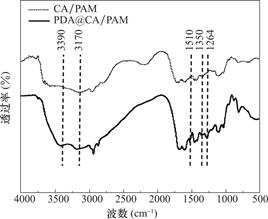
图3 水凝胶的FTIR谱图
Fig.3 FTIR spectra of hydrogels

图4 水凝胶的SEM图像
Fig.4 SEM image of hydrogel
图4是多巴胺吸附前后CA/PAM和PDA@CA/PAM水凝胶的SEM图像。对比CA/PAM和PDA@CA/PAM水凝胶的表面SEM图,可以直观地看到PDA@CA/PAM水凝胶表面有着均匀分布的多巴胺纳米颗粒,说明PDA成功地吸附在水凝胶表面。对比水凝胶的截面SEM图,可以看到PDA吸附前后,水凝胶内部均有着良好的三维多孔网络结构,这也为后续负载药物提供了空间。
2.2 力学性能
防粘连水凝胶应该具有良好的可拉伸及可压缩性能,让水凝胶可以顺利通过狭窄的子宫颈运送到子宫而不断裂,进去子宫到达目标位置以后,可以恢复到正常形状并且适应目标位置形状。图5(a)是CA/PAM和PDA@CA/PAM水凝胶的拉伸应力-应变曲线,可以看到CA/PAM双网络水凝胶有着良好的拉伸性能,PDA涂层的引入,使得PDA@CA/PAM水凝胶的延展率有所降低,这是因为水凝胶表面形成的PDA涂层在水凝胶拉伸的过程中有所束缚,但仍然可以拉伸至初始长度的7倍以上。图5(b)是CA/PAM和PDA@CA/PAM水凝胶的弹性模量和韧性的柱状图。可以看到PDA@CA/PAM水凝胶的弹性模量(5.24±1.06kPa)略高于CA/PAM水凝胶(2.64±0.06kPa),均与天然大鼠子宫组织的模量(2.85±0.12kPa)[34]比较相近,PDA@CA/PAM水凝胶也具有较好的韧性(11.11±0.01MJ/m3)。
图5(c)是PDA@CA/PAM水凝胶在压缩75%时的循环压缩加载-卸载曲线,可以看到第一次压缩时,水凝胶呈现较窄的滞后环,在之后的压缩中水凝胶的加载-卸载曲线与第一次的曲线相似,这意味着PDA@CA/PAM水凝胶循环压缩中较小的能量耗散。PDA@CA/PAM水凝胶优异的抗疲劳性能和自恢复能力主要归因于钙离子交联的海藻酸盐中离子网络的存在。一般来说,未孕妇女的子宫几乎没有宫内压力,偶尔生理性宫缩引起的最大宫内压力不超过20mmHg,循环压缩曲线显示的PDA@CA/PAM水凝胶的压缩性能完全可以承受这种压力。
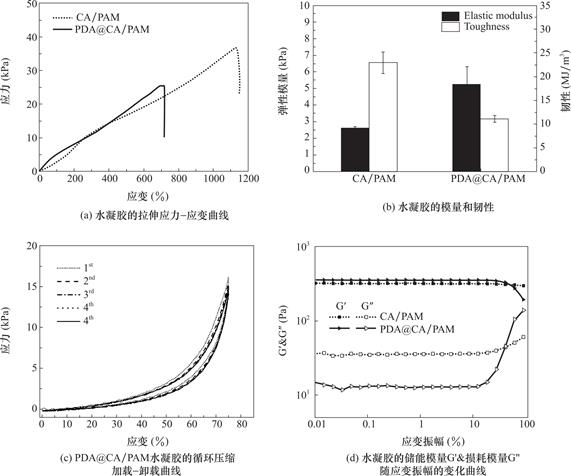
图5 水凝胶的力学性能
Fig.5 Mechanical properties of hydrogels
水凝胶的粘弹性可以反映凝胶内部的交联结构及其相互作用。因此,在37℃,接近人体体温的条件下对水凝胶的剪切黏弹性进行了测试。图5(d)是CA/PAM和PDA@CA/PAM水凝胶的储能模量G'及损耗模量G″随剪切应变振幅的变化曲线。可以看到CA/PAM和PDA@CA/PAM水凝胶在整个应变振幅范围内G'均高于G″,表明凝胶均表现为弹性固体。在0.01%~10%的应变幅值范围内水凝胶的G'和G″均基本保持不变,表明这个范围内凝胶内部网络结构均比较稳定。当应变幅值大于10%时,PDA@CA/PAM水凝胶的G'率先开始下降,G″急速上升,说明PDA@CA/PAM水凝胶内部网络结构已经失去稳定性。从图中也可以发现,CA/PAM和PDA@CA/PAM水凝胶的G'较为接近,但是PDA@CA/PAM水凝胶的G'略高于CA/PAM水凝胶,这也意味着PDA@CA/PAM水凝胶较为密集的交联网络和较高的弹性模量。此外,PDA的引入,PDA@CA/PAM水凝胶的G″降低明显,这是因为在PDA@CA/PAM水凝胶中聚合的PDA链进入CA/PAM网络中和PAM和CA链纠缠,外力会通过分子链均匀消散,导致G″的降低。
2.3 组织粘附性能
防粘连水凝胶需要稳定地粘附在创面发挥屏障作用,因此通过搭接-剪切实验定量地测试了水凝胶与猪皮的粘附强度。图6是CA/PAM和PDA@CA/PAM水凝胶的粘附强度随位移变化的曲线图。实验结果表明,PDA涂层的引入,水凝胶的粘附性能得到了大幅提升,水凝胶与猪皮的粘附强度达到了6.35±0.31kPa,超过纤维蛋白胶的粘附强度(约5kPa)[35]。PDA@CA/PAM水凝胶良好的粘附性能归因于PDA的邻苯二酚、氨基和羧基这些官能团,因为它们模拟了贻贝的粘附相互作用。
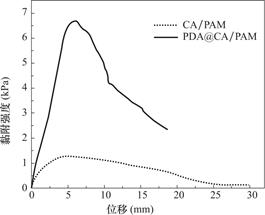
图6 水凝胶的粘附强度-位移曲线
Fig.6 Adhesion strength-displacement curve of hydrogel
2.4 溶胀和体外降解
因为水凝胶吸收液体后迅速膨胀,可以吸收创面处渗液,减少创面渗出,而且也可以有效阻隔受损的子宫壁,防止接触粘连。而宫腔里边有丰富的体液,所以对水凝胶吸收液体溶胀的性能进行了测试。图7(a)是CA/PAM及PDA@CA/PAM水凝胶在PBS溶液(pH=7.4)中随时间的溶胀曲线,可以看到水凝胶在吸收液体24h内会快速吸收液体溶胀,24h以后溶胀率会逐渐减慢直至达到溶胀平衡。PDA@CA/PAM水凝胶的总溶胀率达到约235%,具有良好的溶胀能力。不过,PDA@CA/PAM水凝胶的溶胀率略低于CA/PAM水凝胶(约为292%),这可能是因为聚合的PDA@CA/PAM网络内和PAM及CA链纠缠,使水凝胶的交联度提高,分子链段伸展的能力降低,导致储存水分子的空间减少,溶胀率降低。在水凝胶的溶胀过程中也伴随着水凝胶的降解,PDA@CA/PAM水凝胶的溶胀率在48h后出现了小幅下降,这是因为PDA@CA/PAM水凝胶在48h后降解率开始大于溶胀率。
CA/PAM水凝胶是由Ca2+交联的海藻酸盐网络和由二硫键交联的聚丙烯酰胺网络组成的双网络水凝胶。体液中的Na+与Ca2+交换来降解海藻酸盐网络,体液中的氨基酸如半胱氨酸与二硫键反应可以降解聚丙烯酰胺网络,其中交联剂BAC作为二硫键参与反应[36,20]。因此,在37℃恒温环境下,PBS和20μm半胱氨酸的模拟体液中测试了水凝胶在体外的降解能力,其中20μm半胱氨酸是模拟人体血液中半胱氨酸的浓度![]() 。从图7(b)中可以看出,PDA@CA/PAM水凝胶相较CA/PAM水凝胶在模拟体液中质量损失略有降低,4周后损失约达33%。PDA@CA/PAM水凝胶质量损失降低可能是因为水凝胶表面PDA涂层的存在以及水凝胶内部交联度的提高。这样的降解速度可以保证水凝胶在子宫腔内可以保持一定的时间,以防止粘连复发。
。从图7(b)中可以看出,PDA@CA/PAM水凝胶相较CA/PAM水凝胶在模拟体液中质量损失略有降低,4周后损失约达33%。PDA@CA/PAM水凝胶质量损失降低可能是因为水凝胶表面PDA涂层的存在以及水凝胶内部交联度的提高。这样的降解速度可以保证水凝胶在子宫腔内可以保持一定的时间,以防止粘连复发。
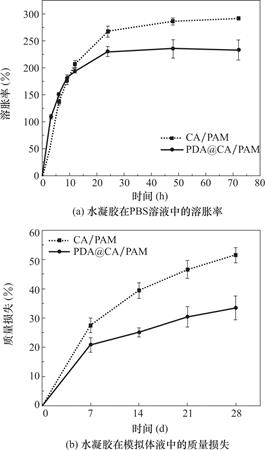
图7 水凝胶在不同时间节点的溶胀及降解质量损失
Fig.7 Swelling and degradation weight loss of hydrogels at different time nodes
2.5 表面亲水性
材料表面的水接触角可以反映材料表面的亲水性,水接触角越小,亲水性能越好。图8是CA/PAM及PDA@CA/PAM水凝胶的水接触角测试,以此来评估水凝胶表面的亲水性。CA/PAM水凝胶的接触角为36.99±1.17°,PDA@CA/PAM水凝胶为21.26±1.08°,可以看到,PDA涂层的引入使水凝胶的接触角明显降低,这便表明水凝胶表面的亲水性能得到提高,这样更利于水凝胶和组织之间的粘附,也利于促进细胞在水凝胶表面的增殖。
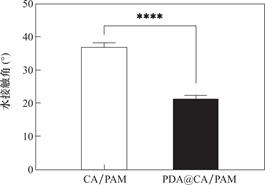
图8 水凝胶表面的水接触角
Fig.8 Water contact angle of hydrogel surface
2.6 生物相容性分析
成纤维细胞在术后粘连的形成中起着极其重要的作用,防粘连材料不应该允许成纤维细胞在材料上快速和不受控制的增殖,也不应具有细胞毒性。于是采用CCK-8方法,用小鼠成纤维细胞(NIH-3T3)评估CA/PAM及PDA@CA/PAM水凝胶浸提液的细胞毒性。图9(a)是NIH-3T3细胞与CA/PAM及PDA@CA/PAM水凝胶的浸提液一起培养1d,2d及3d的细胞活性。可以看出,随着培养时间的增长,CA/PAM及PDA@CA/PAM水凝胶的浸提液都没有抑制细胞生长,两种水凝胶的细胞活性都在80%以上,表明两种水凝胶均有着良好的细胞相容性。从图中还可以发现,引入PDA涂层之后,水凝胶的细胞活性略有提高,说明PDA涂层促进了细胞的增殖。而且NIH-3T3细胞在CA/PAM及PDA@CA/PAM水凝胶浸提液中均没有过度增殖。
防粘连水凝胶作为一种接触血液的材料,根据国际标准(ISO/TR 7405),接触血液的材料溶血率应小于5.0%,材料才可以作为医用材料进行使用![]() 。因此对材料的血液相容性进行了评价,进行了体外溶血实验,图9(b)是CA/PAM及PDA@CA/PAM水凝胶的溶血率,小图是离心后溶血效果的照片。从小图可以明显看出相比于阳性对照去离子水,水凝胶组都没有引起红细胞的破裂,没有发生溶血。溶血率的数据可以看到水凝胶的溶血率均远远低于红线5%,说明CA/PAM及PDA@CA/PAM水凝胶都具有良好的血液相容性。而且PDA@CA/PAM水凝胶的溶血率略低于CA/PAM,表明PDA可以提升材料的血液相容性。
。因此对材料的血液相容性进行了评价,进行了体外溶血实验,图9(b)是CA/PAM及PDA@CA/PAM水凝胶的溶血率,小图是离心后溶血效果的照片。从小图可以明显看出相比于阳性对照去离子水,水凝胶组都没有引起红细胞的破裂,没有发生溶血。溶血率的数据可以看到水凝胶的溶血率均远远低于红线5%,说明CA/PAM及PDA@CA/PAM水凝胶都具有良好的血液相容性。而且PDA@CA/PAM水凝胶的溶血率略低于CA/PAM,表明PDA可以提升材料的血液相容性。
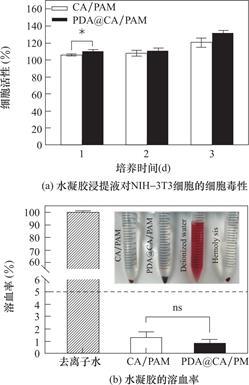
图9 水凝胶的细胞毒性及溶血率
Fig.9 Cytotoxicity and hemolysis rate of hydrogels
3 结论
本文利用表面吸附的方式,在CA/PAM水凝胶表面涂覆PDA,制备得到PDA@CA/PAM水凝胶,用于术后防粘连。具体结论如下:
(1)PDA涂层引入后,CA/PAM水凝胶的组织粘附性能明显提升,PDA@CA/PAM水凝胶与猪皮的粘附强度达到了6.35±0.31kPa,超过纤维蛋白胶的粘附强度(约5kPa)。
(2)CA/PAM及PDA@CA/PAM水凝胶对NIH-3T3细胞的细胞活性均在80%以上,溶血率均在5%以下,说明两种水凝胶均可作为医用材料使用。而且PDA@CA/PAM水凝胶显示出比CA/PAM水凝胶更高的亲水性、细胞相容性及血液相容性。
(3)相比CA/PAM水凝胶,PDA@CA/PAM水凝胶也具有理想的内部多孔结构,与天然大鼠子宫组织接近的弹性模量(5.24±1.06kPa),略低的延展率(720%),较低的溶胀性(235%)及更合适的体外降解速率(4周后损失33%)。PDA@CA/PAM水凝胶也具有良好的抗疲劳及自修复性能。
利益冲突: 作者声明无利益冲突。
[①] *通讯作者 Corresponding author:董旭峰,dongxf@dlut.edu.cn
收稿日期:2022-12-02; 录用日期:2022-12-12; 发表日期:2022-12-28
基金项目:本项研究得到了中央高校基本科研业务费(资助号DUT22YG201)的资助。
参考文献(References)
[1] Yu D, Wong Y M, Cheong Y, et al. Asherman syndrome— one century later[J]. Fertility and Sterility, 2008, 89(4): 759-779.
https: //doi. org/10. 1016/j. fertnstert. 2008. 02. 096
[2] Valle R F, Sciarra J J. Intrauterine adhesions: hysteroscopic diagnosis, classification, treatment, and reproductive outcome[J]. American Journal of Obstetrics and Gynecology, 1988, 158(6): 1459-1470.
https: //doi. org/10. 1016/0002-9378(88)90382-1
[3] Conforti A, Alviggi C, Mollo A, et al. The management of Asherman syndrome: a review of literature[J]. Reproductive Biology and Endocrinology, 2013, 11(1): 1-11.
https: //doi. org/10. 1186/1477-7827-11-118
[4] Sardo A D S, Calagna G, Scognamiglio M, et al. Prevention of intrauterine post-surgical adhesions in hysteroscopy. A systematic review[J]. European Journal of Obstetrics & Gynecology and Reproductive Biology, 2016, 203: 182-192.
https: //doi. org/10. 1016/j. ejogrb. 2016. 05. 050
[5] Guo J, Li T C, Liu Y H, et al. A prospective, randomized, controlled trial comparing two doses of oestrogen therapy after hysteroscopic adhesiolysis to prevent intrauterine adhesion recurrence[J]. Reproductive Biomedicine Online, 2017, 35(5): 555-561.
https: //doi. org/10. 1016/j. rbmo. 2017. 07. 011
[6] Deans R, Abbott J. Review of intrauterine adhesions[J]. Journal of Minimally Invasive Gynecology, 2010, 17(5): 555-569.
https: //doi. org/10. 1016/j. jmig. 2010. 04. 016
[7] Xu W, Zhang Y, Yang Y, et al. Effect of early secondlook hysteroscopy on reproductive outcomes after hysteroscopic adhesiolysis in patients with intrauterine adhesion, a retrospective study in China[J]. International Journal of Surgery, 2018, 50: 49-54.
https: //doi. org/10. 1016/j. ijsu. 2017. 11. 040
[8] Tonguc E A, Var T, Yilmaz N, et al. Intrauterine device or estrogen treatment after hysteroscopic uterine septum resection[J]. International Journal of Gynecology & Obstetrics, 2010, 109(3): 226-229.
https: //doi. org/10. 1016/j. ijgo. 2009. 12. 015
[9] Zhang E, Song B, Shi Y, et al. Fouling-resistant zwitterionic polymers for complete prevention of postoperative adhesion[J]. Proceedings of the National Academy of Sciences, 2020, 117(50): 32046-32055.
https: //doi. org/10. 1073/pnas. 2012491117
[10] Liu H, Xu Y, Yi N, et al. Efficacy and safety of hyaluronic acid gel for the prevention of intrauterine adhesion: a meta-analysis of randomized clinical trials[J]. Gynecologic and Obstetric Investigation, 2018, 83(3): 227-233.
https: //doi. org/10. 1159/000486674
[11] Mao X, Tao Y, Cai R, et al. Cross-linked hyaluronan gel to improve pregnancy rate of women patients with moderate to severe intrauterine adhesion treated with IVF: a randomized controlled trial[J]. Archives of Gynecology and Obstetrics, 2020, 301: 199-205.
https: //doi. org/10. 1007/s00404-019-05368-6
[12] Chandel A K S, Shimizu A, Hasegawa K, et al. Advancement of biomaterial-based postoperative adhesion barriers[J]. Macromolecular Bioscience, 2021, 21(3): 2000395.
https: //doi. org/10. 1002/mabi. 202000395
[13] Reddy S, Santanam N, Reddy P P, et al. Interaction of Interceed oxidized regenerated cellulose with macrophages: a potential mechanism by which Interceed may prevent adhesions[J]. American journal of obstetrics and gynecology, 1997, 177(6): 1315-1321.
https: //doi. org/10. 1016/S0002-9378(97)70070-X
[14] Gibbs D M R, Black C R M, Dawson J I, et al. A review of hydrogel use in fracture healing and bone regeneration[ J]. Journal of Tissue Engineering and Regenerative Medicine, 2016, 10(3): 187-198.
https: //doi. org/10. 1002/term. 1968
[15] Zhang Y S, Khademhosseini A. Advances in engineering hydrogels[J]. Science, 2017, 356(6337): eaaf3627.
https: //doi. org/10. 1126/science. aaf3627
[16] Naahidi S, Jafari M, Logan M, et al. Biocompatibility of hydrogel-based scaffolds for tissue engineering applications[ J]. Biotechnology Advances, 2017, 35(5): 530-544.
https: //doi. org/10. 1016/j. biotechadv. 2017. 05. 006
[17] Burdick J A, Murphy W L. Moving from static to dynamic complexity in hydrogel design[J]. Nature Communications, 2012, 3(1): 1269.
https: //doi. org/10. 1038/ncomms2271
[18] Seliktar D. Designing cell-compatible hydrogels for biomedical applications[J]. Science, 2012, 336(6085): 1124-1128.
https: //doi. org/10. 1126/science. 1214804
[19] Sun J Y, Zhao X, Illeperuma W R K, et al. Highly stretchable and tough hydrogels[J]. Nature, 2012, 489(7414): 133-136.
https: //doi. org/10. 1038/nature11409
[20] Liu J, Pang Y, Zhang S, et al. Triggerable tough hydrogels for gastric resident dosage forms[J]. Nature Communications, 2017, 8(1): 124.
https: //doi. org/10. 1038/s41467-017-00144-z
[21] Yang H, Li C, Tang J, et al. Strong and degradable adhesion of hydrogels[J]. ACS Applied Bio Materials, 2019, 2(5): 1781-1786.
https: //doi. org/10. 1021/acsabm. 9b00103
[22] Lee H, Dellatore S M, Miller W M, et al. Mussel-inspired surface chemistry for multifunctional coatings [J]. science, 2007, 318(5849): 426-430.
https: //doi. org/10. 1126/science. 1147241
[23] Sileika T S, Kim H D, Maniak P, et al. Antibacterial performance of polydopamine-modified polymer surfaces containing passive and active components[J]. ACS Applied Materials & Interfaces, 2011, 3(12): 4602-4610.
https: //doi. org/10. 1021/am200978h
[24] Ding Y H, Floren M, Tan W. Mussel-inspired polydopamine for bio-surface functionalization[J]. Biosurface and Biotribology, 2016, 2(4): 121-136.
https: //doi. org/10. 1016/j. bsbt. 2016. 11. 001
[25] Razavi M, Hu S, Thakor A S. A collagen based cryogel bioscaffold coated with nanostructured polydopamine as a platform for mesenchymal stem cell therapy[J]. Journal of Biomedical Materials Research Part A, 2018, 106(8): 2213-2228.
https: //doi. org/10. 1002/jbm. a. 36428
[26] Wang J, Chen Y, Zhou G, et al. Polydopamine-coated Antheraea pernyi(A. pernyi)silk fibroin films promote cell adhesion and wound healing in skin tissue repair[ J]. ACS Applied Materials & Interfaces, 2019, 11(38): 34736-34743.
https: //doi. org/10. 1021/acsami. 9b12643
[27] Pacelli S, Paolicelli P, Petralito S, et al. Investigating the role of polydopamine to modulate stem cell adhesion and proliferation on gellan gum-based hydrogels[J]. ACS Applied Bio Materials, 2020, 3(2): 945-951.
https: //doi. org/10. 1021/acsabm. 9b00989
[28] Michalicha A, Pałka K, Roguska A, et al. Polydopamine- coated curdlan hydrogel as a potential carrier of free amino group-containing molecules[J]. Carbohydrate Polymers, 2021, 256: 117524.
https: //doi. org/10. 1016/j. carbpol. 2020. 117524
[29] Jing X, Mi H Y, Napiwocki B N, et al. Mussel-inspired electroactive chitosan/graphene oxide composite hydrogel with rapid self-healing and recovery behavior for tissue engineering[J]. Carbon, 2017, 125: 557-570.
https: //doi. org/10. 1016/j. carbon. 2017. 09. 071
[30] Xie Z, Li H, Mi H Y, et al. Freezing-tolerant, widely detectable and ultra-sensitive composite organohydrogel for multiple sensing applications[J]. Journal of Materials Chemistry C, 2021, 9(31): 10127-10137.
https: //doi. org/10. 1039/d1tc02599f
[31] Suneetha M, Rao K M, Han S S. Mussel-inspired cell/ tissue-adhesive, hemostatic hydrogels for tissue engineering applications[J]. ACS omega, 2019, 4(7): 12647-12656.
https: //doi. org/10. 1021/acsomega. 9b01302
[32] Zhang L, Jiang Q, Zhao Y, et al. Strong and tough PAm/SA hydrogel with highly strain sensitivity[J]. Journal of Renewable Materials, 2022, 10(2): 415.
https: //doi. org/10. 32604/jrm. 2022. 016650
[33] Han L, Yan L, Wang K, et al. Tough, self-healable and tissue-adhesive hydrogel with tunable multifunctionality[ J]. NPG Asia Materials, 2017, 9(4): e372-e372.
https: //doi. org/10. 1038/am. 2017. 33
[34] Xiao B, Yang W, Lei D, et al. PGS scaffolds promote the in vivo survival and directional differentiation of bone marrow mesenchymal stem cells restoring the morphology and function of wounded rat uterus[J]. Advanced Healthcare Materials, 2019, 8(5): 1801455.
https: //doi. org/10. 1002/adhm. 201801455
[35] Lih E, Lee J S, Park K M, et al. Rapidly curable chitosan- PEG hydrogels as tissue adhesives for hemostasis and wound healing[J]. Acta Biomaterialia, 2012, 8(9): 3261-3269.
https: //doi. org/10. 1016/j. actbio. 2012. 05. 001
[36] Li J, Suo Z, Vlassak J J. Stiff, strong, and tough hydrogels with good chemical stability[J]. Journal of Materials Chemistry B, 2014, 2(39): 6708-6713.
https: //doi. org/10. 1039/c4tb01194e
[37] Brigham M P, Stein W H, Moore S. The concentrations of cysteine and cystine in human blood plasma[J]. The Journal of Clinical Investigation, 1960, 39(11): 1633-1638.
https: //doi. org/10. 1172/JCI104186
[38] Cai N, Li Q, Zhang J, et al. Antifouling zwitterionic hydrogel coating improves hemocompatibility of activated carbon hemoadsorbent[J]. Journal of Colloid and Interface Science, 2017, 503: 168-177.
https: //doi. org/10. 1016/j. jcis. 2017. 04. 024
[39] Deng X, Wang T, Zhao F, et al. Poly(ether sulfone)/ activated carbon hybrid beads for creatinine adsorption [J]. Journal of Applied Polymer Science, 2007, 103(2): 1085-1092.
https: //doi. org/10. 1002/app. 25344
[40] Zhou C, Yi Z. Blood-compatibility of polyurethane/liquid crystal composite membranes[J]. Biomaterials, 1999, 20(22): 2093-2099.
https: //doi. org/10. 1016/S0142-9612(99)00080-0
Preparation and Properties of Polydopamine Coated Modified Calcium Alginate/Polyacrylamide Anti-adhesive Hydrogel
(1. School of Materials Science and Engineering, Dalian University of Technology, Dalian 116024, China
2. Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China)
Abstract: Film and hydrogel materials are mainly used as anti-adhesion barriers to prevent intrauterine adhesions (IUA) after surgery, but the efficacy of materials currently used in clinical practice is still not satisfactory due to insufficient adhesion and rapid degradation. Calcium alginate/polyacrylamide (CA/PAM) double-network hydrogel has excellent mechanical properties and biocompatibility, which is suitable for anti- adhesion materials, but the adhesion is insufficient and easy to shift. In this paper, polydopamine (PDA) coating was used to modify the CA/PAM hydrogel, and PDA@CA/PAM hydrogel was prepared to improve its adhesion properties. The SEM images show that the PDA coating is successfully applied, and that the hydrogel has a good three-dimensional porous network structure. The mechanical property test showed that the hydrogel had excellent tensile and compressibility, which allowed it to enter the target location smoothly and withstand certain pressure. The lap-shear test demonstrated that the modification of PDA coating significantly improved the tissue adhesion properties of CA/PAM hydrogels. The swelling and degradation properties indicated that the hydrogel could absorb the wound exudate and keep it on the wound for a certain period of time. The introduction of PDA coating also improved the hydrophilicity of the hydrogel. Cytotoxicity tests and hemolysis experiments showed that the cell activity of hydrogel was above 80%, and the hemolysis rate was below 5%. Moreover, PDA@CA/PAM hydrogel showed higher cell compatibility and blood compatibility than that of CA/PAM.
Keywords: Anti-adhesion, hydrogel, polydopamine, sodium alginate, polyacrylamide
DOI: 10.48014/pcms.2022120202002
Citation: XUE Beibei, WANG Zhaoyuan, DONG Xufeng. Preparation and properties of polydopamine coated modified calcium alginate/polyacrylamide anti-adhesive hydrogel[J]. Progress in Chinese Materials Sciences, 2022, 1(3): 45-56.