

单宁酸止血材料研究进展
(大连理工大学 材料科学与工程学院, 大连 116024)
摘要: 单宁酸是一类植物多酚, 广泛存在于五倍子、茶叶等天然草本植物中, 具有止血、消炎、抗菌、抗氧化等功能。其结构中含有丰富的儿茶酚基团, 表现出极高的反应活性, 不仅可与血细胞、血浆蛋白等发生作用, 促进血管收缩、血液凝固; 也可与生物大分子、金属离子、合成高分子结合, 制备成水凝胶、海绵、涂层、颗粒等多种形式; 还可以解决伤口愈合过程中出血、感染、氧化等诸多问题, 具有制备高性能止血材料的潜力。近年来, 研究人员报道了许多形式多样、制备简单、性能优异的单宁酸止血材料, 引起了国内外学者的广泛关注。因此本文聚焦于单宁酸的止血特性, 归纳总结了单宁酸的止血机理和相关止血材料的设计思路; 依据材料类型和产品特点对常见的单宁酸止血材料进行了总结; 最后对其可能存在的不足和以后的发展方向进行了探讨, 以期为深入研究单宁酸止血材料提供可靠依据。
DOI: 10.48014/pcms.20230309002
引用格式: 徐盼, 董旭峰, 齐民. 单宁酸止血材料研究进展[J]. 中国材料科学进展, 2023, 2(2): 8-23.
文章类型: 研究性论文
收稿日期: 2023-03-09
接收日期: 2023-03-26
出版日期: 2023-06-28
0 引言
出血是手术或者战争创伤中存在的普遍现象[1],也是导致休克或者死亡的主要原因之一,会给患者带来极大的痛苦。小范围内的出血可以自愈,而大量的、不可控制的出血或者凝血障碍患者的失血常常导致死亡[2]。在现有医疗环境下,失血过多造成的死亡依然是亟待解决的问题。因此,研究人员致力于开发能够快速止血的材料,针对各种止血材料展开了广泛而深入的研究。理想的用于伤口愈合的止血材料应能迅速控制出血,可以应用于不同类型的伤口,具有良好的生物相容性和无细胞毒性,易于清除或生物降解,易于加工,并在能够在储存期间保持性能稳定[3]。目前止血材料已有许多较为成熟的种类,例如止血海绵、纱布、止血粉等。但是传统的止血材料等在使用时存在止血时间长、易感染、易发炎等问题,需要经常更换,容易损伤创口。针对这些问题,人们开始研究新的方式对其进行改进。单宁酸具有良好的生物学性能,在止血、抗菌、消炎、抗氧化、促进创口愈合等方面有显著效果,早在我国古代就有以单宁酸为主要成分的止血剂消炎剂的例子[4]。因此,现代许多研究也将单宁酸引入体系之中制备出了具有良好止血性能和综合性能的材料。
1 单宁酸的简介
1.1 单宁酸的理化性质
单宁酸(Tannic acid,TA),分子式为C76H52O46,是一种植物基的天然多酚,来源广泛,价格低廉,常应用于日化[5]、食品[6]、医疗[7]等领域。其分子结构式如图1所示,每个单宁酸分子由中间的葡萄糖核和外围的5个邻苯二酚基团、5个邻苯三酚基团构成。苯酚结构含有疏水的苯环和亲水的羟基,既可以作为氢供体也可以作为氢受体参与反应,表现出极高的反应活性,也赋予了TA许多重要的性能。
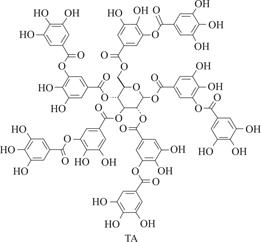
图1 单宁酸的结构式[8]
Fig.1 Structural formula of tannic acid[8]
首先单宁酸可以与蛋白质、多糖、生物碱等生物大分子发生反应。例如可以使酒中的蛋白质杂质沉淀,或者用于鞣制皮革增加其柔韧性。这种易与蛋白质反应的性能被称为单宁酸的收敛性。Haslam提出的“手套-手”机制很好地解释了这一点[9]。由于疏水作用,当多酚靠近蛋白质时会优先向蛋白质中疏水基团较为集中的地方接近,附近的氨基酸侧链因此紧密围绕多酚分子形成疏水袋,袋内的氨基、羟基等基团与多酚以氢键形式结合,最终形成复合物。这种特性使得单宁酸在生理环境中具有极大的优势,能与细胞、细菌表面或者生物体内的蛋白质结合,表现出止血、抗菌、抗病毒等性能。
其次,单宁酸可以与金属离子螯合[10]。Guo等[11]研究发现TA可以与Fe3+、Zn2+、Cu2+等16种金属离子形成稳定的配位化合物。这是因为TA分子中存在的邻位酚羟基易形成氧负离子,围绕一个中心的金属离子配位,形成稳定的环状螯合物。并且在螯合过程中TA也可能与金属离子发生静电相互作用,或者对金属离子进行还原,例如将Fe3+、Ag+等还原至低价态甚至是金属纳米颗粒[12]。因此,研究人员常常利用单宁酸向材料中引入具有功能性的金属离子,从而提升导电性、导热性、生物学性能等。例如TA还原银纳米颗粒的引入可以提升材料的抗菌能力[10];在材料表面通过共价/非共价作用制备的TA/Ca2+涂层能有效激活凝血酶、血小板和凝血因子,缩短凝血时间[13];设计材料时加入单宁酸与Fe3+形成的配合物纳米颗粒可用于光热转换[14]、消炎杀菌,等等。
第三,使用单宁酸制备的材料具有普遍黏附性,表现出优越的皮肤亲和力和水下黏附能力[15]。对单宁酸黏附性能的研究最早是由贻贝黏附现象衍生而来。贻贝能够牢固地黏附在各种水下表面而不脱落。人们研究发现实现这种湿黏附的关键是贻贝蛋白中存在的邻苯二酚基团[16],它可以与材料表面的-NH2,-SH,-OH和-COOH等基团相互作用,产生氢键、金属配位、Π-Π堆积、硫醇还原等作用,从而有效地附着在各种基材表面[17]。TA分子中存在5个邻苯二酚基团,是贻贝仿生材料中较为典型的一种,已被制成多种黏附材料、胶粘剂[10],适用于各种潮湿的血液、体液环境,表现出良好的水下黏附能力[18]。
1.2 单宁酸的生物学性能
单宁酸的多元酚结构赋予它一系列独特的化学性质,也因此表现出许多优异的生物学性能,例如止血、抗菌、消炎、抗氧化、抗癌等等,已被美国食品和药物管理局批准用于食品和医药[19],在生物医药的多个领域都有所应用。
(1)单宁酸的止血性能及机理
单宁酸又称鞣质,是药材五倍子的主要有效成分之一[4]。五倍子具有良好的敛汗止血效果,在临床上常用于治疗消化道出血[20,21]、便血痔血[21]、外伤出血,在《本草纲目》、《本草拾遗》、《开宝本草》等医书中均有收录,常见的药物产品有复方止血消炎软膏[22]。作为其主要成分,单宁酸也具有止血作用[23],在许多研究中都表现出优异的止血性能[24]。
对于单宁酸止血机理的研究,还尚未有定论,认可度较高的说法是单宁酸具有良好的生理活性,可以与某些血液内容物发生反应,使血液凝固,从而止血。首先,单宁酸可以改变红细胞的表面性质,促进其凝聚。1929年的一项研究表明,单宁酸可以降低红细胞表面的亲水性,使得表面电位发生变化,从而聚集红细胞[25,26]。Boyden[27]对此现象进行了深入探索,发现单宁酸不仅能够凝聚红细胞,还能提升红细胞对某些蛋白质的吸附能力。其次,单宁酸可以促进血小板的生成[28],这是因为TA会加速巨噬细胞的分化和成熟,起到升血小板的作用,因此TA可以促进血液中血细胞的增殖和聚集。此外,由于TA与蛋白质发生反应的特性,当在血液环境中时,单宁酸结构中的酚羟基会与血浆蛋白的氨基通过疏水相互作用和氢键相互作用产生交联[29],形成血液凝块[24],快速凝血。这种对血浆蛋白的吸附、交联,也会包裹血液中的血细胞,促进红细胞、血小板的黏附、激活[30],达到止血效果。除了可与血液内容物发生反应之外,也有研究认为单宁酸是一种带负电的酚类分子,可以与血浆蛋白中的亲核分子产生强相互作用,从而激活凝血因子Ⅻ,提高材料的止血能力[31,32]。
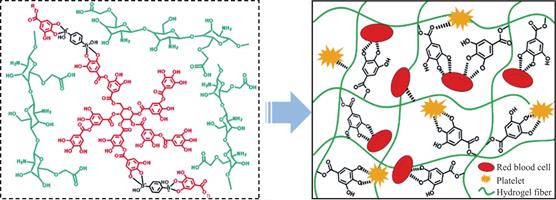
图2 单宁酸水凝胶与血细胞作用的机理示意图[31]
Fig.2 Schematic diagram of the mechanism of the interaction between tannic acid hydrogels and blood cells [31]
综上,单宁酸的止血机理可以分为两部分。一方面,TA可以吸附红细胞、血小板,促进血小板的生成,将红细胞和血小板富集于创口处,促进血液凝固;另一方面,单宁酸会与血液中的多种蛋白质产生相互作用,使其凝结,包裹血细胞,产生凝血。因此,当TA直接接触血液时,表现出良好的凝血能力[24]。
(2)单宁酸的其他生物学性能
除了止血性能之外,单宁酸还有许多其他优异的生物学性能。例如单宁酸可以与细菌表面蛋白质作用,破坏细菌的细胞壁及细胞膜[33] 、抑制细菌生物膜的形成[34],从而杀菌并抑制细菌增殖 。TA结构中的邻苯酚基团有很强的供氢能力,可以捕捉组织中的活性氧(Reactive Oxygen Species,ROS),抑制自由基,达到抗氧化的效果[35,37-39]。此外,单宁酸还被发现能够刺激成纤维细胞生长因子的分泌[40],促进伤口愈合[35,37];抑制多种癌细胞的生长、增殖并促进其凋亡[41,42]等。因而单宁酸可以解除伤口愈合过程中微生物感染、活性氧生成、延迟凝血和慢性炎症的限制[43],对制备高性能生物医用材料具有重要意义。
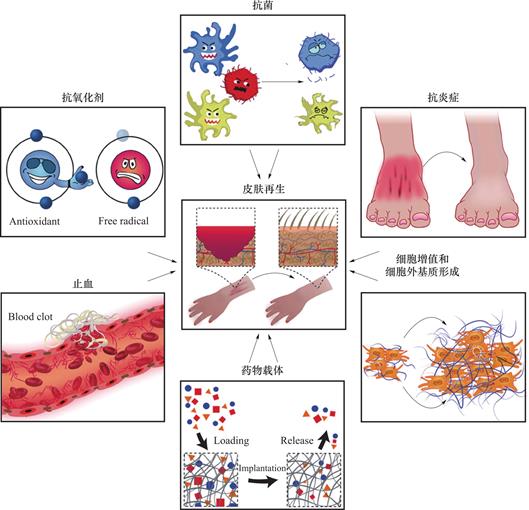
图3 单宁酸复合水凝胶在伤口愈合过程中的作用示意图[44]
Fig.3 Schematic diagram of the action of tannic acid composite hydrogels in the process of wound healing [44]
1.3 单宁酸止血材料的设计思路
在开发止血材料时,首先应当明确应用背景和产品需求,依据各项要求提出关键的性能指标,再针对这些指标进行材料设计。Guo[3]提出了设计止血材料时要考虑的两个主要因素:活性化学成分和材料形式。单宁酸作为一种具有良好的理化性质和生物学性能的植物多酚,十分适合作为活性成分加入材料中。依据不同的创口类型及材料要求,可以将TA止血材料的设计思路分为以下几种。
首先是针对生活中常见的浅层创口,如刮伤、擦伤等。这类创口出血量小、愈合时间短,产品需求量大、商用品类多,对止血的要求不高。研究的重心应当放在降低生产成本、增加材料的使用舒适度和多功能性上。因此可以在止血海绵、止血凝胶等成熟产品的基础上,直接将单宁酸作为止血组分加入其中,利用单宁酸与血细胞、血浆蛋白之间的相互作用,促进血液凝块产生而止血。同时TA也可以兼顾抗菌、消炎、促愈合的问题,价格低廉,完美契合材料要求。其次针对出血多而急的深层创口,例如动脉出血,需要快速堵住出血口防止产生过多失血,因此需要设计能耐受动脉压冲击并且牢牢黏附在创口上的高强高黏材料。可以仿照贻贝黏附的机理,利用单宁酸良好的水下黏附效果,制备止血胶粘剂、封闭剂。单宁酸基胶粘剂具有良好的水下黏附性,能够黏附湿态组织并封闭出血创口,防止血液渗漏。TA的强交联作用使得材料具有较高的强度,从而抵挡血流阻止血液流失,表现出优异的止血封闭效果。第三种设计思路是针对褥疮和糖尿病足伤口等反复溃烂出血甚至坏死的慢性病创口。这类创口对材料要求极高,不仅需要止血抗菌还需要具有透气性、可更换性,能够承受背部、足部压力、促进“退糖”、能够监测创口恢复情况等等,单一的材料难以满足性能要求。因此可以凭借单宁酸无毒并且可以和生物大分子、金属等材料发生反应的特性,组合多种材料。例如,Liu等[45]向聚丙烯酰胺-丙烯酸腺嘌呤聚合物网络中引入单宁酸修饰的聚吡咯纳米颗粒,制备出的高透明导电水凝胶贴片能够加速止血、预防创面感染,并且可以直观地监测创面愈合状态、实现间接血糖监测,在糖尿病足的治疗方面具有重大意义。这种利用单宁酸引入多种材料的方式有利于构建多组元体系,获得具有良好综合性能的止血材料。上述思路是TA止血材料的设计中较为常见的,在实际应用中可以将这几种思路结合,以制备出理想的止血材料。
2 单宁酸止血材料的分类
先进止血材料的设计往往较为复杂,因此本文依据材料形式对单宁酸止血材料进行了分类。大致可以分为止血水凝胶、止血胶黏剂、止血海绵、止血涂层和止血颗粒五大类。
2.1 止血水凝胶
水凝胶是一类含水量极高的聚合物,类似细胞外基质,具有可控的力学性能和良好的生物相容性[46],可以保持伤口表面湿润并十分易于制备和改性,在生物医用材料方面应用广泛。单宁酸分子中含有丰富的羟基,可以通过形成氢键、离子键、配位键等多种方式参与止血水凝胶的制备,具有极大的应用潜力。
(1)固定形状水凝胶
由于单宁酸与生物大分子反应的特性,研究人员常常使用单宁酸作为蛋白质、多糖等天然材料的交联剂[15]。Zhou等[47]以凝胶多糖和单宁酸为原材料,通过杂化退火的方式合成了一种适用于伤口愈合全过程的止血抗菌水凝胶。研究发现该材料在体温下可以持续释放单宁酸,当在大鼠尾部创口使用该杂化水凝胶时,失血量和止血时间明显减少,表现出抑制出血和促进凝血的特性。Shin等[48]直接混合TA和DNA,提出了一种快速制备大量DNA基止血水凝胶的新技术。在制备过程中,单宁酸与DNA链上的磷酸二酯键交联,当[DNA的碱基对]/[单宁酸]的化学计量比约为1时,水凝胶会自发稳定形成,并能封装和释放DNA。由于材料中含有TA,表现出良好的组织黏附性和显著的止血性能,使小鼠肝脏出血模型的止血时间从133s缩短至53s。
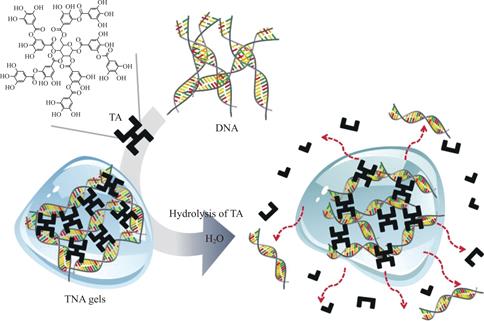
图4 单宁酸-DNA水凝胶在伤口愈合过程中的作用示意图[44]
Fig.4 Schematic diagram of the role of tannic acid-DNA hydrogels in the wound healing process [44]
上述单宁酸交联的天然材料水凝胶已被证实具有良好的止血性能,但其天然基体通常十分柔软,机械性能较差,因此可以将TA与人工材料结合,或者引入一些无机填料来改变这个缺点。例如Fan等[49]使用单宁酸作为交联剂,制备了多重氢键交联的聚丙烯酰胺-单宁酸水凝胶,在保持高韧高强的同时能有效黏合组织,十分契合黏附止血水凝胶的要求。有研究者对其进行了改进[50],在原有基体上添加硅酸铝黏土矿物,作为额外的物理交联剂增强水凝胶,并研究了其止血性能。发现改性后的水凝胶可抵抗5.65MPa的外界压力,黏附强度提升至基体的20倍,达到50kPa,可迅速黏附并封闭出血创口。在体外试验中将大鼠股动脉止血时间从148s缩短至24s,表现出极佳的止血性能。Zeng[51]在更换另一种无机纳米颗粒进行实验后,也得到了类似的结论,所以这种聚丙烯酰胺-单宁酸-无机颗粒的止血材料体系可能是通用的,值得在之后的研究中进一步探索。
(2)无定形水凝胶
固定形状水凝胶制备简单,是研究的最为广泛的一种,但难以贴合不规则创口,使用存在一定的局限性。由于单宁酸具有极高的反应活性,能够快速聚合,因此研究人员使用TA设计了多种可注射水凝胶。使用时,无定形的水凝胶前体溶液会迅速凝固,可以匹配伤口形状,相较于固定形状水凝胶,能够更好地黏附并填补创口,阻止出血。Geng等[31]成功合成了一种可注射、可喷洒的多酚水凝胶,通过TA和羧甲基壳聚糖之间形成的氢键和TA与苯硼酸间形成的动态硼酸酯键进行自组装,10s左右即可快速凝固填充创口,使小鼠肝脏出血量减少77%。对经血液处理过的水凝胶进行红外测试发现-OH和-C=O的吸收峰都发生偏移,表明是血液和水凝胶组分间的强相互作用产生快速凝血。Ahmadian[44]简单混合明胶和单宁酸,制备了具有pH响应性的多功能止血水凝胶。该水凝胶数十秒即可成型,具有明显的多孔结构和较高的溶胀率,可以迅速集中凝血因子,TA等活性组分也可以促进止血。应用于鼠尾断口时可将止血时间缩短至1min,失血量也明显降低。
2.2 止血胶黏剂
在临床上常常会遇到一些大出血的病例,需要快速堵住出血口,但如何抵挡高压血流的冲击是一个十分困难的问题。可注射水凝胶能够填充创口,但难以应对动脉出血等情况,其前体溶液在凝固之前就可能被高压血流冲散,并且黏附强度和机械性能也较低,封闭效果不好。针对此问题,研究人员提出了止血胶黏剂和封闭剂的概念,例如纤维蛋白胶、聚乙二醇粘附剂和仿生黏附封闭剂等[52]。单宁酸含有丰富的儿茶酚基团,具有良好的湿黏附性能,并且氧化为邻醌的儿茶酚基团还能促进蛋白质和聚合物的交联反应,使材料具有内聚性和弹性,表现出更高的强度。因此作为仿贻贝黏附材料中较为典型的一种,得到了广泛的应用。Kim等[53]通过直接混合聚乙二醇和单宁酸制备了一种名为TAPE的医用胶粘剂,与纤维蛋白胶相比,黏附强度增加了250%,可以在至少60次黏附-分离循环中保持良好的黏附稳定性,紧密封闭创口。在同样的受伤情况下,出血量不到纤维蛋白胶组的三分之一,表现出良好的止血性能。并且这种新型TAPE材料是可以降解的,在初始的11天内观察到了80%的降解,更有利于创口的恢复和生长。Zhang等[54]使用单宁酸和N-羟乙基丙烯酰胺制备出了止血黏附剂,与猪皮的黏附强度最高可达38.51kPa,并且冷冻干燥再水合之后仍能保持初始良好的黏附性和止血性能,十分适合作为紧急情况下自救的黏性止血材料。
为了进一步提升材料的止血能力,福州大学Yang[55]课题组不仅模仿贻贝足蛋白的化学成分,还模仿其层次结构,制备了一种止血胶粘剂SFT。相较之前的仿贻贝黏附研究,SFT形成分层组装结构的机制更为简单,只需使用单宁酸和丝素蛋白直接混合。TA中丰富的酚羟基触发了SF从随机线圈到β-片的构象转变,形成直径为30nm左右的纤维,并自发组装而形成如图8(c)所示的纳米纤维。这种纤维结构使得胶粘剂具有良好的机械韧性,达到123.1±11.5kJ/m3。体外黏附测试表明,胶黏剂在1min时黏附强度达到86.1kPa,20min后的黏附强度达到134.1kPa,能够应用于潮湿和动态环境,例如密封跳动的心脏和充满液体的肠道。由于SFT中的酚部分与血蛋白中的亲核试剂之间的强相互作用,加速了血小板聚集和凝血因子的激活,因此 SFT的存在可以使血液凝固时间减少到0.8min左右,有利于体内快速止血。之后,该团队进一步对其进行了优化,在原有基础上加入了壳聚糖,制备了一种具有多孔结构的止血胶粘剂[32]。相较之前的纤维结构,新的多孔结构赋予了它快速吸液的能力,止血效率达到前述报道的最高值96.5%±2.1%,并且该材料基本无细胞毒性,在局部急性伤口和大出血中表现出色。综上,单宁酸基止血封闭剂克服了商用密封剂湿态附着能力差、细胞毒性大、难以降解[52,56]等缺点,表现出极大的发展潜力。
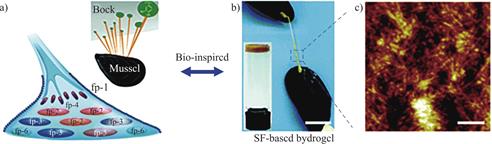
图5 仿生单宁酸基水凝胶密封胶的设计(a)贻贝足蛋白示意图,附图为黏着在岩石表面的贻贝; (b)单宁酸基密封胶用作人工缝线连接两只贻贝表面;(c)密封胶典型纳米纤维结构的AFM图像,比例尺:200nm[55]
Fig.5 Design of a bionic tannin acid-based hydrogel sealant(a)Schematic diagram of mussel foot protein with an attached mussel adhering to the rock surface;(b)tannic acid-based sealant used as an artificial suture to connect the surface of two mussels;(c)AFM image of the typical nanofiber structure of the sealant,scale bar:200nm[55]
2.3 止血海绵
面对出血量大、创伤面积大的严重创口时,人们常常使用具有较高孔隙率的止血海绵以快速止血。传统的商用海绵存在降解过快、力学性能差、脆性大、炎症反应剧烈等等问题,因此研究人员使用单宁酸对其做出了许多改进。例如,为了改善传统壳聚糖海绵降解性能差的缺陷,蓝广芊[57]团队用单宁酸交联壳聚糖/明胶材料,通过冷冻干燥法制备了一种止血海绵,6周后即可完全降解,是一类可吸收的止血海绵材料。针对壳聚糖海绵脆性大的问题,Cao等[58]引入单宁酸作为二级交联剂,合成了一种双交联壳聚糖海绵。壳聚糖中的-NH2与海绵中的单宁酸的邻苯没食子酸形成大量氢键,显著提高了海绵的水/血稳定性。研究发现添加TA之后海绵的柔韧性提升,更不容易损伤创口。并且材料的抗菌性能和抗氧化性增强,失血量和止血时间随TA的增加而减少,止血效果明显。
Yu等[59]报道了一种具有良好柔韧性、光热抗菌性和吸湿性的止血海绵,以壳聚糖/丝素蛋白作为支架,单宁酸/铁离子(TA/Fe3+)作为光热治疗的刺激反应剂。添加单宁酸之后,材料的孔径变细,并且失血量、止血时间、体外凝血指数都有所下降,红细胞形态也更加稳定,呈现典型的圆盘状。这证明单宁酸-金属离子络合物的引入有助于提升材料的止血效果。基于类似的思考,Chen等[60]制备了一种TA/Cu2+交联的季铵盐壳聚糖和羧化纤维素纳米纤维基海绵CQTC。该海绵具有能快速止血和伤口愈合的微通道结构。如图6 所示,加入TA/Cu2+做交联剂之后,在水凝胶原有的管壁结构之间出现了连接,呈现出相互连通的三维通孔。TA/Cu2+相当于这个海绵框架中的“钢筋”,使海绵的孔隙结构更加牢固,更不容易受到损坏,按压之后可以恢复原始形状。高达99.7%的孔隙率赋予了材料快速止血的特性,也更有利于伤口换气,阻止厌氧菌的繁殖,表现出单宁酸改性海绵在止血和伤口愈合方面的优势和潜在应用。
2.4 止血涂层
由于TA可以和生物大分子结合,以及和金属离子形成配位配合物,从而吸附于各种尺寸、结构以及不同材料的表面[39,61],因此可以被用于在不同基底上制作涂层材料。为了提升涂层的牢固度和性能,常常通过交替吸附,逐层组装(Layer-by-layer,LbL)的方式制成多层[62]涂层材料,涂覆于纱布[29]、止血海绵[13,63]、注射器针头[64]、导管[65]或者支架等表面,应用广泛。

图6 单宁酸海绵的孔状结构及按压循环图
(a)季铵盐化壳聚糖海绵QCS的扫描电镜图;(b)季铵盐壳聚糖和羧化纤维素纳米纤维海绵CQTC0的扫描电镜图; (c)-(f)不同单宁酸和铜离子含量的止血海绵CQTC1.5,CQTC3,CQTC5,CQTC10扫描电镜图;(g)单宁酸海绵CQTC的压缩循环图[60]
Fig.6 Pore structure and pressing cycle diagram of tannic acid sponge (a)SEM spectra of Quaternized chitosan sponge(QCS);(b)SEM spectra of Quaternized chitosan(QCS)and Carboxylated cellulose nanofibers(CCNF)sponge CQTC0;(c)-(f)SEM spectra of CQTC hemostatic sponges with different contents of tannic acid and copper ion:CQTC1.5,CQTC3,CQTC5;CQTC10;(g)compression cycle diagram of tannic acid sponge CQTC in compression[60]
科学家首先在纱布、海绵等常规材料表面进行了实验。这类材料主要是通过孔隙结构吸收血液,浓缩凝血因子达到止血效果。因而在其表面制备涂层时,需要注意不能堵塞孔隙,影响多孔结构。Shukla等[63]探索了在明胶海绵表面制备单宁酸/凝血酶涂层的方法。传统的涂层制备方法不适合蛋白质,也难以满足凝血酶在pH7.4的活性要求。因此该团队选用单宁酸为原料,通过氢键相互作用在凝血酶稳定的状态下用喷雾LBL法组装了活性凝血涂层。测试发现(凝血酶/单宁酸)n膜的厚度在纳米级别且厚度可控。当负载于明胶海绵衬底时,不会影响其孔隙结构和吸液能力。并且单宁酸涂层可以释放活性凝血酶,在60s内完成止血,比传统的明胶海绵止血时间缩短了104s。类似的,Song等[29]在医用纱布上组装了TA-Fe络合涂层,明显提升了纱布对血浆蛋白和纤维蛋白原的吸附能力,能快速形成血栓,血液在15min完全凝结。如图7所示,Tan[13]在甲壳素纳米纤维海绵表面逐层沉积锚定单宁酸/钙离子制备了涂层。引入该涂层之后,材料的孔径没有明显的变化,抗压缩性能、抗菌性能和止血性能都有所提升。可以通过多孔结构和TA、钙离子的释放提升材料的血小板聚集活性,实现双重止血。
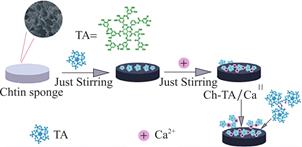
图7 单宁酸在海绵表面涂层形成示意图[13]
Fig.7 Schematic diagram of formation of tannic acid coating on sponge surface[13]
止血涂层不仅可以制备在止血材料的表面,也可以直接制备在医疗器械表面以阻止微创创口处的出血,简化后续止血操作流程,降低患者不适。如图8所示,为了改善穿刺手术中的出血问题,Yin等使用单宁酸和明胶通过简单的混合-沉积-涂覆-干燥的方法制备了能应用于动脉穿刺的止血针。该止血针头表面包被干态水凝胶涂层,穿刺时可原位形成固相-水凝胶转变,封堵创口[64]。止血涂层经体外测试可抵抗990mmHg的爆破压力,黏附力达到30.7kPa,比海藻酸钠水凝胶(2.3kPa)和纤维蛋白胶(8.6kPa)的黏附力要高得多,同时,在大鼠腹主动脉和静脉穿刺中都能够实现完全止血,并且不形成血栓,血管内血液仍保持正常流动。由上述研究可见,使用单宁酸制备止血涂层能够引入从蛋白质到多糖的一系列大分子,不受界面修饰剂和表面之间的化学特异性的要求,也不受复杂仪器的使用和底物大小和形状的限制,是一种通用的自组装技术。
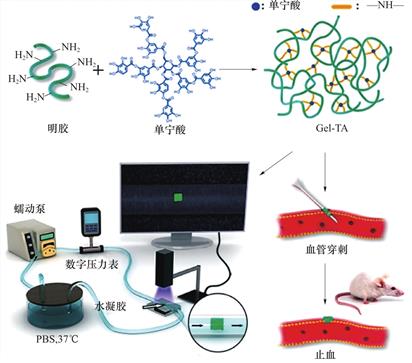
图8 单宁酸止血涂层的形成和止血针体外评价示意图[64]
Fig.8 Schematic diagram of the formation of tannic acid hemostatic coating and illustration of the hemostatic needle in vitro evaluation[64]
2.5 止血颗粒
止血颗粒以其便携、能够适应多种创口,快速止血等特点而为人们所熟知,但是常规的无机止血颗粒例如矿物沸石、蒙脱土、高岭土、介孔二氧化硅等存在使用时放热,易造成烧伤和难以剥离创口、易残留、生物相容性不好、降解性能差等问题[66]。因此,研究人员利用TA对这些止血颗粒进行了改进,例如,Wang等[67]在介孔二氧化硅微粒(Mesoporous Silica Nanoparticles,MSN)表面负载单宁酸,明显改善了材料的血液相容性和凝血性能。通过共价耦联和静电吸附,在二氧化硅颗粒表面接枝了单宁酸,阻止红细胞直接接触MSN表面,降低了材料的溶血率。当材料接触血液时,会迅速释放单宁酸,与血浆蛋白交联,快速止血。并且研究发现,随着TA负载量的增加,出血控制和抗菌效率同时提高,体外和体内止血时间缩短65%,表现出极佳的综合性能。Chen等[68]利用单宁酸与金属离子之间的相互作用,设计了一种钙交联单宁酸包被介孔二氧化硅/银Janus纳米颗粒。选用多步法,先制备了负载银离子的纳米颗粒,再用单宁酸还原颗粒表面的银离子,最后将颗粒浸入钙离子溶液中与邻苯三酚基团络合,形成了不对称的Ca-TA-MSN@Ag纳米止血颗粒。该颗粒具有高比表面积(510.62m2/g)和大孔体积(0.48m3/g),能够快速浓缩血液中的水分。材料中含有的单宁酸、钙离子和负电颗粒三种凝血因子协同作用,诱导红细胞聚集,加速凝血级联反应,促进止血。与纯二氧化硅微粒相比,Ca-TA-MSN@Ag将止血时间缩短至50%左右。
单宁酸不仅可以对无机止血颗粒进行改进,还可以用于设计新型的有机止血颗粒。Liu等[65]通过将带正电的季胺化淀粉和单宁酸交替组装在多孔淀粉微粒上,制备了具有良好血液相容性的淀粉基止血微粒。研究发现,最外层为多酚层的止血颗粒具有显著变好的血小板黏附/激活和红细胞黏附性能,止血性能也最好,能有效治疗体内顽固性出血。如图9所示,Li等[24]以单宁酸为交联剂,淀粉、羧甲基壳聚糖、透明质酸为原料设计了一种能够促愈合的多糖止血微粒。在接触血液时可以吸收水分原位形成水凝胶,与组织二次交联封闭创口。通过测试活化部分凝血活酶时间(Activated Partial Thromboplastin Time,APTT)和凝血酶原时间(Prothrombin Time,PT)发现这种微粒可以同时激活内源性和外源性止血通路,快速吸收并浓缩血液,将凝血时间由436.8s缩短至126s。而且与商用材料Celox相比,单宁酸止血微粒对革兰阴性菌和阳性菌均表现出更好的广谱抗菌活性,可在14天内迅速修复伤口,具有重要的临床应用前景。
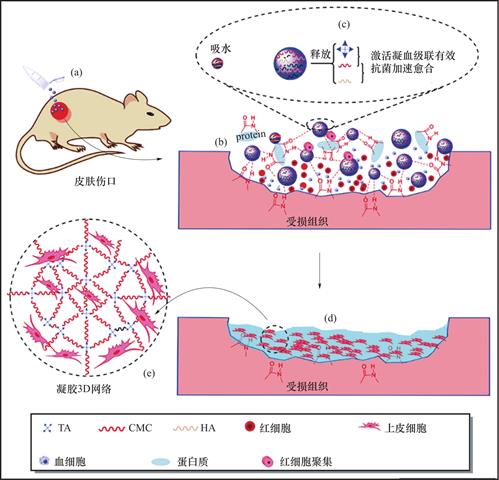
图9 多糖止血微粒在受损组织处的作用机制图(a)将微粒涂抹在伤口表面;(b)微粒与组织发生二次交联; (c)微粒吸水膨胀,释放TA;(d)在创口表面形成水凝胶;(e)水凝胶为不同细胞的增殖和迁移提供了三维网络结构[24]
Fig.9 Diagram of mechanism of action of polysaccharide hemostatic particles at damaged tissues.(a)Application of the particles on the wound surface;(b)Secondary cross-linking between particles and tissue;(c)Particles absorb water and expand to release TA;(d)formation of a hydrogel on the wound surface;(e)Hydrogel provides a 3D network structure for the proliferation and migration of different cells[24]
3 总结及展望
单宁酸作为一种具有极高反应活性和良好生物学性能的植物多酚,可以提升材料的止血、抗菌黏附等性能,是一类十分有前景的材料改性剂。目前已经报道的典型单宁酸止血材料如表1所示。
表1 典型单宁酸止血材料
Table 1 Typical hemostatic materials based on tannic acid
|
材料类型 |
原材料 |
优点 |
止血效果 |
参考文献 |
|
止血水凝胶 |
TA、DNA |
制备简单、黏附、可降解 |
小鼠肝脏创口53s止血 |
[48] |
|
|
TA、丙烯酰胺、高岭土纳米粒子 |
高韧、高强、高黏附 |
大鼠股动脉创口24s止血 |
[50] |
|
|
TA、明胶 |
pH响应性、可载药、抗菌 |
大鼠断尾创口67s止血 |
[31] |
|
止血胶黏剂 |
TA、聚乙二醇 |
黏附强度比纤维蛋白胶增加250%,可降解 |
小鼠肝脏创口120s止血,失血量为纤维蛋白胶组的 |
[53] |
|
|
TA、丝素蛋白 |
具有仿贻贝蛋白层次结构、高韧性、高黏附 |
大鼠肝脏创口立即止血,失血量为氰基丙烯酸酯组的 |
[55] |
|
止血海绵 |
TA、季铵盐化壳聚糖、羧化纤维素纳米纤维、Cu2+ |
具有分层多孔结构、高孔隙率、高吸液率、抗菌 |
小鼠断尾、肝撕裂止血模型、股动脉止血模型的止血时间分别为81s、40s、206s |
[60] |
|
止血涂层 |
TA、Fe3+ |
涂层长期稳定、可吸附纤维蛋白原 |
兔耳静脉创口45s止血 |
[29] |
|
止血颗粒 |
TA、介孔二氧化硅 |
低溶血率、抗菌 |
大鼠断尾创口123s止血 |
[67] |
|
|
TA、淀粉、羧甲基壳聚糖、透明质酸 |
激活内源性和外源性止血通路、良好的生物相容性、抗菌 |
大鼠肝脏、股动脉创口止血时间分别为85s、97s |
[24] |
由上表可见TA止血材料制备简单,无须引入额外的交联剂、引发剂、促进剂;形式多样,已被制备成水凝胶、海绵、涂层、颗粒等多种形式;性能优异,可以提升材料的凝血、抗菌性能,表现出明显的优势,但在实际应用中仍存在着一定的问题。例如单宁酸在反应过程中极易氧化,且氧化过程难以控制。氧化形成的醌结构一方面可以增加材料的内聚性,提升材料强度,另一方面会降低材料的黏附性,因此设计TA黏附止血材料时需要依据性能要求,充分协调氧化过程。其次单宁酸材料可以通过释放TA达到止血、抗菌的效果,但不受控制的释放可能会损伤组织,引起炎症,因此需要探索缓解突释现象的方法,例如通过包埋、吸附的方式提升其缓释性能。最后单宁酸基止血材料常常具有极佳的黏附性,也被认为生物相容性良好和可以降解,但在某些情况下仍然需要面临更换和拆除问题,所以如何达到黏附材料的无创拆除将会是将来的研究重点。综上,单宁酸在止血材料的制备及应用方面具有明显的优势,但仍存在需要改进的地方,应当综合调控反应条件,以期制得性能更优的TA止血材料。
利益冲突: 作者声明无利益冲突。
[①] *通讯作者 Corresponding author:董旭峰,dongxf@dlut.edu.cn
收稿日期:2023-03-09; 录用日期:2023-03-26; 发表日期:2023-06-28
基金项目:中央高校基本科研业务费(资助号:DUT22YG201)资助。
参考文献(References)
[1] CHAMPION H R, BELLAMY R F, ROBERTS C P, et al. A Profile of Combat Injury[J]. Journal of Trauma and Acute Care Surgery, 2003, 54(5): S13-S19.
https://doi.org/10.1097/01.TA.0000057151.02906.27
[2] BEHRENS A M, SIKORSKI M J, KOFINAS P. Hemostatic strategies for traumatic and surgical bleeding[J]. Journal of Biomedical Materials Research Part A, 2014, 102(11): 4182-4194.
https://doi.org/10.1002/jbm.a.35052
[3] GUO B, DONG R, LIANG Y, et al. Haemostatic materials for wound healing applications[J]. Nature Reviews Chemistry, 2021, 5(11): 773-791.
https://doi.org/10.1038/s41570-021-00323-z
[4] 郭姝彤, 刘永仙, 艾彩莲, 等. 五倍子有效成分提取分离、药理作用及临床应用研究进展[J]. 陕西中医, 2015, 36(06): 762-764.
[5] SHI J, PUIG R, SANG J, et al. A comprehensive evaluation of physical and environmental performances for wet-white leather manufacture[J]. Journal of Cleaner Production, 2016, 139: 1512-1519.
https://doi.org/10.1016/j.jclepro.2016.08.120
[6] 黄国柱. 用单宁酸预防黄酒非生物混浊的研究[J]. 酿酒科技, 2002(05): 67-68.
[7] 常丽, 陈安国, 黄思齐, 等. 单宁酸在抗菌及伤口愈合中的研究进展[J]. 中国麻业科学, 2022, 44(01): 63-68.
[8] ZHANG X Y, LIU M Y, ZHANG X Q, et al. Interaction of tannic acid with carbon nanotubes: enhancement of dispersibility and biocompatibility[J]. Toxicology Research, 2015, 4(1): 160-168.
DOI:10.1039/c4tx00066h
[9] HASLAM E, LILLEY T H, CAI Y, et al. Traditional herbal medicines - the role of polyphenols[J]. Planta Medica, 1989(1): 1-8.
[10] GUO J, SUN W, KIM J P, et al. Development of tannininspired antimicrobial bioadhesives[J]. Acta Biomater, 2018, 72: 35-44.
https://doi.org/10.1016/j.actbio.2018.03.008
[11] GUO J L, PING Y, EJIMA H, et al. Engineering Multifunctional Capsules through the Assembly of Metal- Phenolic Networks[J]. Angewandte Chemie-International Edition, 2014, 53(22): 5546-5551.
https://doi.org/1002/anie.201311136
[12] YI Z, LI X, XU X, et al. Green, effective chemical route for the synthesis of silver nanoplates in tannic acid aqueous solution[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2011, 392(1): 131-136.
https://doi.org/10.1016/j.colsurfa.2011.09.045
[13] TAN L, ZHOU X, WU K, et al. Tannic acid/Ca(II)anchored on the surface of chitin nanofiber sponge by layer- by-layer deposition: Integrating effective antibacterial and hemostatic performance[J]. Int J Biol Macromol, 2020, 159: 304-315.
https://doi.org/10.1016/j.ijbiomac.2020.05.098
[14] WANG Y, LIU F, YAN N, et al. Exploration of Fe(III)-Phenol Complexes for Photothermal Therapy and Photoacoustic Imaging[J]. ACS Biomater Sci Eng, 2019, 5(9): 4700-4707.
https://doi.org/10.1021/acsbiomaterials.9b00711
[15] CHEN C, YANG H, YANG X, et al. Tannic acid: a crosslinker leading to versatile functional polymeric networks: a review [J]. RSC Adv, 2022, 12(13): 7689-7711.
https://doi.org/10.1039/d1ra07657d
[16] LEE H, DELLATORE S M, MILLER W M, et al. Mussel-inspired surface chemistry for multifunctional coatings[J]. Science, 2007, 318(5849): 426-430.
https://doi.org/10.1126/science.1147241
[17] ZHANG W, WANG R X, SUN Z M, et al. Catecholfunctionalized hydrogels: biomimetic design, adhesion mechanism, and biomedical applications[J]. Chemical Society Reviews, 2020, 49(2): 433-464.
https://doi.org/10.1039/c9cs00285e
[18] KE X, DONG Z, TANG S, et al. A natural polymer based bioadhesive with self-healing behavior and improved antibacterial properties[J]. Biomater Sci, 2020, 8(15): 4346-4357.
https://doi.org/10.1039/d0bm00624f
[19] NINAN N, FORGET A, SHASTRI V P, et al. Antibacterial and Anti-Inflammatory pH-Responsive Tannic Acid-Carboxylated Agarose Composite Hydrogels for Wound Healing[J]. ACS Applied Materials & Interfaces, 2016, 8(42): 28511-28521.
https://doi.org/10.1021/acsami.6b10491
[20] 程胜平, 周世龙, 陆维宏. 内镜直视下应用中药复方石榴皮五倍子诃子液对上消化道出血的疗效观察[J]. 中华中医药学刊, 2014, 32(02): 432-434.
https://doi.org/10.13193/j.issn.1673-7717.2014.02.073
[21] 樊祥堃, 潘翠屏. 五倍子液的制备及临床应用报告[J]. 苏州医学院学报, 1997(03): 430-431.
[22] 宋昕祁, 管咏梅, 张建林, 等. 复方止血消炎软膏抗炎抑菌作用的实验研究[J]. 江西中医药, 2019, 50(12): 62-65.
[23] 王鑫淼, 许杨, 王崧, 等. 植物化合物对血小板功能的影响[J]. 西部中医药, 2018, 31(01): 126-131.
[24] LI N, YANG X, LIU W, et al. Tannic Acid Cross-linked Polysaccharide-Based Multifunctional Hemostatic Microparticles for the Regulation of Rapid Wound Healing[J]. Macromol Biosci, 2018, 18(11): e1800209.
https://doi.org/10.1002/mabi.201800209
[25] FREUND J. Phagocytosis of Red Blood-Cells Treated by Tannin[J]. Proceedings of the Society for Experi- mental Biology and Medicine, 1929, 26(9): 876-878.
https://doi.org/10.3181/00379727-26-4568
[26] FREUND J. On the Mechanism of Toxin-Antitoxin Reactions[ J]. The Journal of Immunology, 1931, 21(2): 127-137.
https://doi.org/10.4049/jimmunol.21.2.127
[27] BOYDEN S V. The adsorption of proteins on erythrocytes treated with tannic acid and subsequent hemagglutination by antiprotein sera[J]. Journal of Experimental Medicine, 1951, 93(2): 107-120.
https://doi.org/10.1084/jem.93.2.107
[28] 吴苏南. 单宁酸对血小板生成的影响及抗辐射作用研究[D]. 重庆: 第三军医大学, 2015.
[29] SONG B, YANG L, HAN L, et al. Metal Ion-Chelated Tannic Acid Coating for Hemostatic Dressing[J]. Materials( Basel), 2019, 12(11): 1803.
https://doi.org/10.3390/ma12111803
[30] LIU J Y, HU Y, LI L, et al. Biomass-Derived Multilayer- Structured Microparticles for Accelerated Hemostasis and Bone Repair[J]. Advanced Science, 2020, 7(22): 2002243.
https://doi.org/10.1002/advs.202002243
[31] GENG H, DAI Q, SUN H, et al. Injectable and Sprayable Polyphenol-Based Hydrogels for Controlling Hemostasis[J]. ACS Applied Bio Materials, 2020, 3(2): 1258-1266.
https://doi.org/10.1021/acsabm.9b01138
[32] QIAO Z, LV X, HE S, et al. A mussel-inspired supramolecular hydrogel with robust tissue anchor for rapid hemostasis of arterial and visceral bleedings[J]. Bioact Mater, 2021, 6(9): 2829-2840.
https://doi.org/10.1016/j.bioactmat.2021.01.039
[33] DONG G F, LIU H Y, YU X, et al. Antimicrobial and anti-biofilm activity of tannic acid against Staphylococcus aureus[J]. Natural Product Research, 2018, 32(18): 2225-2228.
https://doi.org/10.1080/14786419.2017.1366485
[34] SAMOILOVA Z, TYULENEV A, MUZYKA N, et al. Tannic and gallic acids alter redox-parameters of the medium and modulate biofilm formation[J]. Aims Microbiology, 2019, 5(4): 379-392.
https://doi.org/10.3934/microbiol.2019.4.379
[35] NATARAJAN V, KRITHICA N, MADHAN B, et al. Preparation and properties of tannic acid cross-linked collagen scaffold and its application in wound healing[J]. J Biomed Mater Res B Appl Biomater, 2013, 101(4): 560-567.
https://doi.org/10.1002/jbm.b.32856
[36] LEE J H, PARK J H, CHO H S, et al. Anti-biofilm activities of quercetin and tannic acid against Staphylococcus aureus[J]. Biofouling, 2013, 29(5): 491-499.
https://doi.org/10.1080/08927014.2013.788692
[37] GAO X, XU Z, LIU G, et al. Polyphenols as a versatile component in tissue engineering[J]. Acta Biomater, 2021, 119: 57-74.
https://doi.org/10.1016/j.actbio.2020.11.004
[38] FAN H, WANG L, FENG X, et al. Supramolecular Hydrogel Formation Based on Tannic Acid[J]. Macromolecules, 2017, 50(2): 666-676.
https://doi.org/10.1021/acs.macromol.6b02106
[39] DU Y, QIU W Z, WU Z L, et al. Water-Triggered Self- Healing Coatings of Hydrogen-Bonded Complexes for High Binding Affinity and Antioxidative Property[J]. Advanced Materials Interfaces, 2016, 3(15): 1600167.
https://doi.org/10.1002/admi.201600167
[40] CHEN Y Q, TIAN L B, YANG F Y, et al. Tannic Acid Accelerates Cutaneous Wound Healing in Rats Via Activation of the ERK 1/2 Signaling Pathways[J]. Advances In Wound Care, 2019, 8(7): 341-354.
https://doi.org/10.1089/wound.2018.0853
[41] 王宏英, 魏海峰, 王卫芳, 等. 单宁酸对肾癌细胞生长的抑制作用及其机制[J]. 中国免疫学杂志, 2019, 35(17): 2089-2093.
[42] DARVIN P, BAEG S J, JOUNG Y H, et al. Tannic acid inhibits the Jak2/STAT3 pathway and induces G1/S arrest and mitochondrial apoptosis in YD-38 gingival cancer cells[J]. International Journal of Oncology, 2015, 47(3): 1111-1120.
https://doi.org/10.3892/ijo.2015.3098
[43] RODRIGUES M, KOSARIC N, BONHAM C A, et al. Wound Healing: A Cellular Perspective[J]. Physiol Rev, 2019, 99(1): 665-706.
https://doi.org/10.1152/physrev.00067.2017
[44] AHMADIAN Z, CORREIA A, HASANY M, et al. A Hydrogen-Bonded Extracellular Matrix-Mimicking Bactericidal Hydrogel with Radical Scavenging and Hemostatic Function for pH-Responsive Wound Healing Acceleration[J]. Adv Healthc Mater, 2021, 10(3): e2001122.
https://doi.org/10.1002/adhm.202001122
[45] LIU H, LI Z, CHE S, et al. A smart hydrogel patch with high transparency, adhesiveness and hemostasis for allround treatment and glucose monitoring of diabetic foot ulcers[J]. J Mater Chem B, 2022, 10(30): 5804-5817.
https://doi.org/10.1039/d2tb01048h
[46] LIANG Y, HE J, GUO B. Functional Hydrogels as Wound Dressing to Enhance Wound Healing[J]. ACS Nano, 2021, 15(8): 12687-12722.
https://doi.org/10.1021/acsnano.1c04206
[47] ZHOU Z, XIAO J, GUAN S, et al. A hydrogen-bonded antibacterial curdlan-tannic acid hydrogel with an antioxidant and hemostatic function for wound healing[J]. Carbohydr Polym, 2022, 285: 119235.
https://doi.org/10.1016/j.carbpol.2022.119235
[48] SHIN M, RYU J H, PARK J P, et al. DNA/Tannic Acid Hybrid Gel Exhibiting Biodegradability, Extensibility, Tissue Adhesiveness, and Hemostatic Ability[J]. Advanced Functional Materials, 2015, 25(8): 1270-1278.
https://doi.org/10.1002/adfm.201403992
[49] FAN H, WANG J, JIN Z. Tough, Swelling-Resistant, Self-Healing, and Adhesive Dual-Cross-Linked Hydrogels Based on Polymer-Tannic Acid Multiple Hydrogen Bonds[J]. Macromolecules, 2018, 51(5): 1696-1705.
https://doi.org/10.1021/acs.macromol.7b02653
[50] FAN X, WANG S, FANG Y, et al. Tough polyacrylamide- tannic acid-kaolin adhesive hydrogels for quick hemostatic application[J]. Mater Sci Eng C Mater Biol Appl, 2020, 109: 110649.
https://doi.org/10.1016/j.msec.2020.110649
[51] 曾娜. 介孔二氧化硅/单宁酸复合水凝胶止血材料的制备及性能研究[D]. 延吉: 延边大学, 2022.
https://doi.org/10.27439/d.cnki.gybdu.2022.000650
[52] MEHDIZADEH M, YANG J. Design strategies and applications of tissue bioadhesives[J]. Macromol Biosci, 2013, 13(3): 271-288.
https://doi.org/10.1002/mabi.201200332
[53] KIM K, SHIN M, KOH M Y, et al. TAPE: A Medical Adhesive Inspired by a Ubiquitous Compound in Plants[J]. Advanced Functional Materials, 2015, 25(16): 2402-2410.
https://doi.org/10.1002/adfm.201500034
[54] ZHANG D F, XU Z Y, LI H F, et al. Fabrication of strong hydrogen-bonding induced coacervate adhesive hydrogels with antibacterial and hemostatic activities[J]. Biomaterials Science, 2020, 8(5): 1455-1463.
https://doi.org/10.1039/c9bm02029b
[55] BAI S, ZHANG X, CAI P, et al. A silk-based sealant with tough adhesion for instant hemostasis of bleeding tissues[J]. Nanoscale Horizons, 2019, 4(6): 1333-1341.
https://doi.org/10.1039/c9nh00317g
[56] ANNABI N, ZHANG Y N, ASSMANN A, et al. Engineering a highly elastic human protein-based sealant for surgical applications[J]. Science Translational Medicine, 2017, 9(410): eaai7466.
https://doi.org/10.1126/scitranslmed.aai7466
[57] LAN G, LU B, WANG T, et al. Chitosan/gelatin composite sponge is an absorbable surgical hemostatic agent[J]. Colloids and Surfaces B: Biointerfaces, 2015, 136: 1026-1034.
https://doi.org/10.1016/j.colsurfb.2015.10.039
[58] CAO S, XU G, LI Q, et al. Double crosslinking chitosan sponge with antibacterial and hemostatic properties for accelerating wound repair[J]. Composites Part B: Engineering, 2022, 234: 109746.
https://doi.org/10.1016/j.compositesb.2022.109746
[59] YU Y, LI P, ZHU C, et al. Multifunctional and Recyclable Photothermally Responsive Cryogels as Efficient Platforms for Wound Healing[J]. Advanced Functional Materials, 2019, 29(35): 1904402.
https://doi.org/10.1002/adfm.201904402
[60] CHEN J, ZHAO L, LING J, et al. A quaternized chitosan and carboxylated cellulose nanofiber-based sponge with a microchannel structure for rapid hemostasis and wound healing[J]. Int J Biol Macromol, 2023: 123631.
https://doi.org/10.1016/j.ijbiomac.2023.123631
[61] EJIMA H, RICHARDSON J J, LIANG K, et al. One- Step Assembly of Coordination Complexes for Versatile Film and Particle Engineering[J]. Science, 2013, 341(6142): 154-157.
https://doi.org/10.1126/science.1237265
[62] KOZLOVSKAYA V, ZAVGORODNYA O, CHEN Y, et al. Ultrathin polymeric coatings based on hydrogenbonded polyphenol for protection of pancreatic islet cells[J]. Adv Funct Mater, 2012, 22(16): 3389-3398.
https://doi.org/10.1002/adfm.201200138
[63] SHUKLA A, FANG J C, PURANAM S, et al. Hemostatic multilayer coatings[J]. Adv Mater, 2012, 24(4): 492-496.
https://doi.org/10.1002/adma.201103794
[64] YIN X, REN J, LAN W, et al. Microfluidics-assisted optimization of highly adhesive haemostatic hydrogel coating for arterial puncture[J]. Bioact Mater, 2022, 12: 133-142.
https://doi.org/10.1016/j.bioactmat.2021.10.009
[65] LIU L, SHI H C, YU H, et al. One-step hydrophobization of tannic acid for antibacterial coating on catheters to prevent catheter-associated infections[J]. Biomaterials Science, 2019, 7(12): 5035-5043.
https://doi.org/10.1039/c9bm01223k
[66] KHEIRABADI B S, MACE J E, TERRAZAS I B, et al. Safety Evaluation of New Hemostatic Agents, Smectite Granules, and Kaolin-Coated Gauze in a Vascular Injury Wound Model in Swine[J]. Journal of Trauma-Injury Infection and Critical Care, 2010, 68(2): 269-277.
https://doi.org/10.1097/TA.0b013e3181c97ef1
[67] WANG C, ZHOU H, NIU H, et al. Tannic acid-loaded mesoporous silica for rapid hemostasis and antibacterial activity[J]. Biomater Sci, 2018, 6(12): 3318-3331.
https://doi.org/10.1039/c8bm00837j
[68] CHEN J, QIU L, LI Q, et al. Rapid hemostasis accompanied by antibacterial action of calcium crosslinking tannic acid-coated mesoporous silica/silver Janus nanoparticles[J]. Mater Sci Eng C Mater Biol Appl, 2021, 123: 111958.
https://doi.org/10.1016/j.msec.2021.111958
Research Progress of Hemostatic Materials based on Tannic Acid
(School of Materials Science and Engineering, Dalian University of Technology, Dalian 116024, China)
Abstract: Tannic acid is a class of plant polyphenols, which widely exists in natural herbs such as Chinese gallnut and tea. It has the functions of hemostasis, anti-inflammatory, antibacterial, and antioxidant. Its structure is rich in catechol groups and exhibits extremely high reactivity, which can not only interact with blood cells and plasma proteins to promote vasoconstriction and blood coagulation, but also combine with biological macromolecules, metal ions and synthetic polymers to prepare hydrogels, sponges, coatings, particles, or other forms; it can also solve many problems related to bleeding, infection, and oxidation during wound healing, and has the potential to prepare high-performance hemostatic materials. Recently, researchers have reported various tannic acid hemostatic materials that are simple to prepare and have excellent properties, attracting widespread attention from scholars at home and abroad. Therefore, this paper focuses on the hemostatic properties of tannic acid, and summarizes the hemostatic mechanism of tannic acid and the design ideas of related hemostatic materials; summarizes the common tannin hemostatic materials were summarized based on material types and product characteristics; finally, discusses the possible limitations and future development directions, to provide a reliable basis for in-depth research on tannic acid hemostatic materials.
Keywords: Tannic acid, plant polyphenols, hemostatic mechanism, hemostatic materials
DOI: 10.48014/pcms.20230309002
Citation: XU Pan, DONG Xufeng, QI Min. Research progress of hemostatic materials based on Tannic Acid[J]. Progress in Chinese Materials Sciences, 2023, 2(2): 8-23.