

取代率可调的降冰片烯改性壳聚糖的研究
(上海时代天使医疗器械有限公司, 上海 200433)
摘要: 壳聚糖因其产量丰富, 同时具有生物安全性、可降解性和抗菌抗炎等特性, 而受到医疗行业广泛关注。但是壳聚糖的水溶性较差, 限制了其应用。将壳聚糖改性, 制备成可溶于水的壳聚糖水凝胶, 例如可光固化交联的水凝胶, 可使其广泛应用于细胞培养、组织工程、3D打印等领域。在光固化交联中, 巯基-降冰片烯点击反应因其极高的反应速率而值得被关注。本研究通过改变反应参数包括反应物的量、反应时间和反应体系酸碱度三个物理量, 制备了一系列降冰片烯改性壳聚糖水凝胶, 并提出了使用核磁共振氢谱技术来表征其取代率的计算方法。研究发现, 在壳聚糖改性的反应体系中同时发生取代反应和酸酐水解反应, 两个反应相互影响, 对反应参数的综合调节可以调控反应速率以及产物的取代率, 本研究的取代率可在9%~43%范围内变化。本研究中的降冰片烯改性壳聚糖水凝胶具有超过50%的吸水率, 其优秀的吸水能力使其可以应用于伤口敷料、药物递送等领域。
关键词: 壳聚糖, 降冰片烯基团, 巯基-烯点击反应, 核磁共振氢谱
DOI: 10.48014/pcms.20240901001
引用格式: 吕诗达. 取代率可调的降冰片烯改性壳聚糖的研究[J]. 中国材料科学进展, 2024, 3(4): 42-53.
文章类型: 研究性论文
收稿日期: 2024-09-01
接收日期: 2024-09-24
出版日期: 2024-12-28
1 引言
壳聚糖是甲壳素最重要的衍生物,甲壳素是仅次于纤维素的第二丰富的天然聚合物,产量丰富,价格便宜。壳聚糖可以通过甲壳素的脱乙酰化来制备,脱乙酰化程度范围为60%至100%。在脱乙酰化过程中,甲壳素上的乙酰基被去除并被氨基取代。壳聚糖及其衍生物具有良好的生物安全性和生物可降解性,同时具有抑菌,止血,促进伤口愈合等功能[1-4]。因此其在医疗领域具有很大的潜能,例如口腔疾病治疗、伤口敷料、骨修复等[5-7]。但是壳聚糖在中性溶液中溶解度较差,使用酸性溶液如醋酸等才能促进其溶解。该特性限制了其部分潜在应用,因此对壳聚糖的改性,以增加其水溶性成为了近些年重要的研究方向[8]。其中,使用可发生光固化交联的官能团对壳聚糖进行改性,形成壳聚糖改性水凝胶是一个典型的研究领域,改性后的壳聚糖水凝胶可用于组织工程、3D打印等生物医用领域[9]。
在光固化交联反应中,巯基-烯点击反应不同于自由基聚合反应,具备诸多优点,如反应效率高、无副产物、反应温度和条件温和、对氧气不敏感等[10,11]。因此,其广泛应用于多个领域,包括表面改性[12],细胞培养[13],组织工程等[14]。巯基-烯点击反应的机理可以简要描述为巯基中的氢原子被光引发剂提取,形成巯基自由基。随后巯基自由基传播到“烯”基团,形成碳自由基。由碳自由基引发硫醇基团的下一次氢提取,产生另一个巯基自由基和硫醚键,直至发生自由基-自由基耦联终止,反应完成[15-17]。巯基-烯点击反应的反应速率取决于“烯”基团和硫醇基团的类型。在大多数情况下,“烯”基团的反应速率随着碳-碳双键电子密度的降低而降低[16]。如Hoyle等人所报道的,与三种典型硫醇基团发生反应的通用“烯”基团遵循以下反应顺序:降冰片烯>乙烯基醚>丙烯基>烯烃≈乙烯基酯>N-乙烯基酰胺>烯丙基醚~烯丙基三嗪~烯丙基三嗪>N-乙烯酰胺>烯丙醚~烯丙基异氰尿酸酯>丙烯酸酯>不饱和酯>N-取代马来酰亚胺>丙烯腈~甲基丙烯酸酯>苯乙烯>共轭二烯。
其中的例外是第一个反应性最高的降冰片烯和最后三个反应性低的“烯”基团。甲基丙烯酸酯、苯乙烯和共轭二烯的低反应性是由于碳自由基的高稳定性以及后续化学链延伸过程中较低的氢提取率[18]。
巯基-降冰片烯反应异常高的反应速率来自两个原因:在降冰片烯双键上添加巯基自由基引起了显著的环状结构的应变释放,以及碳自由基可以快速提取巯基中的氢原子[18]。因此,与其他巯基-烯点击反应相比,巯基-降冰片烯点击反应还存在额外的优点。首先,如前所述巯基-降冰片烯的反应速率远高于其他巯基-烯点击反应。其次,在巯基-降冰片烯点击反应中不发生均聚反应[19,20]。降冰片烯可以通过开环复分解聚合、乙烯基加成或阳离子/自由基聚合,但用于巯基-烯点击反应的光引发剂不能催化降冰片烯的聚合[21,22],因此,通常情况下,反应体系中需要硫醇交联剂来固化降冰片烯改性水凝胶。第三,由于无均聚反应发生,基于巯基-降冰片烯反应的光聚合反应无氧抑制作用。最后,由于没有氧抑制,光引发剂浓度和辐照光强度可以远低于其他反应[23]。据报道,引发巯基-降冰片烯点击反应的光引发剂苯基-2,4,6-三甲基苯甲酰膦酸锂(lithium phenyl-2,4,6-trimethylbenzoylphosphinate,LAP)的浓度可低至50μM [15]。
本研究在先前研究的基础上进行改进[24],通过调控反应参数,制备了一系列(共20组)具有不同取代程度的降冰片烯改性壳聚糖(norbornene-functionalized chitosan,chitosan-NB)水凝胶,使用红外光谱对改性后的结构进行定性表征。同时采用核磁共振氢谱(1H nuclear magnetic resonance,1H NMR)对降冰片烯改性壳聚糖的化学结构进行定量表征,依据1H NMR结果计算改性壳聚糖中的降冰片烯的取代率(degree of substitution,DS)。将降冰片烯改性壳聚糖水凝胶固化后测试其水吸附和解吸能力,以评估其在医用材料领域的应用潜力。
2 实验
2.1 材料
壳聚糖(分子量:190-310kDa,脱乙酰化度75%-85%),顺式-5-降冰片烯-2,3-二羧酸酐,乙酸,氯化氘(DCl),氧化氘(D2O),N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF),氢氧化钠(NaOH),1,4-二硫苏糖醇(1,4-Dithiothreitol,DTT)等均来自Sigma-Aldrich。
2.2 降冰片烯改性壳聚糖的制备
在这项研究中,定制了三个反应参数来控制降冰片烯的取代率,包括反应物(顺式-5-降冰片烯-2,3-二羧酸酐)的量、反应时间和反应体系的酸碱性(碱/无碱处理)(base treatment/no base treatment),20组取代反应参数详见表1。反应物的量以摩尔比(mole ratio)的形式表示,即顺式-5-降冰片烯-2,3-二羧酸酐上的降冰片烯基团数与壳聚糖链上的氨基团数之间的比率。
将壳聚糖(2 wt%)溶解在3 wt%乙酸(200ml)中,在室温下连续磁力搅拌过夜得到壳聚糖溶液。20组样品按表1中对应摩尔比,将相应量的顺式-5-降冰片烯-2,3-二羧酸酐溶解在DMF(40ml)中,并在连续磁力搅拌下使用注射驱动器以500μL/min的速率加入上述壳聚糖溶液中,注射完成后静置,各组静置时间分别如表1中要求的反应时间所示。对于G1-G10组,静置完成后通过手动滴加NaOH(1mol/L)对体系进行碱处理,将体系的pH值调节至9,再继续搅拌6小时。对于G11-G20组,不进行碱处理,直接继续搅拌6小时。搅拌完成后,通过加入冰醋酸将经过碱处理的G1-G10组体系的pH调节回6。最后对所有组溶液进行透析,待透析完成后,对溶液进行冷冻干燥,获得20组样品。
表1 用于制备具有不同取代率的降冰片烯改性壳聚糖的反应参数
Table 1 Reaction parameters for preparing chitosan-NB with different DS
|
No. |
Mole ratio |
Reaction Time/hour |
pH |
No. |
Mole ratio |
Reaction Time/hour |
pH |
|
G1 |
0.5∶1 |
24 |
base treatment |
G11 |
0.5∶1 |
24 |
no base treatment |
|
G2 |
1∶1 |
G12 |
1∶1 |
||||
|
G3 |
2.5∶1 |
G13 |
2.5∶1 |
||||
|
G4 |
5∶1 |
G14 |
5∶1 |
||||
|
G5 |
1∶1 |
48 |
G15 |
1∶1 |
48 |
||
|
G6 |
2.5∶1 |
G16 |
2.5∶1 |
||||
|
G7 |
5∶1 |
G17 |
5∶1 |
||||
|
G8 |
1∶1 |
72 |
G18 |
1∶1 |
72 |
||
|
G9 |
2.5∶1 |
G19 |
2.5∶1 |
||||
|
G10 |
5∶1 |
G20 |
5∶1 |
2.3 傅里叶红外光谱表征(Fourier Transform infrared spectroscopy,FTIR)
傅里叶红外光谱仪表征了壳聚糖、降冰片烯改性壳聚糖的化学结构。使用NICOLET 5700分光光度计(Thermo Fisher Scientific,UK)收集红外光谱谱图,光谱扫描范围为 4000cm-1 至 400cm-1,平均扫描 64 次,分辨率为 4cm-1。
2.4 1H NMR表征
将壳聚糖或各组降冰片烯改性壳聚糖溶于0.5%(v/v)氯化氘/氧化氘(DCl/D2O)中,制备浓度为5 mg/ml的溶液,其中氯化氘的添加是为了提高壳聚糖的水溶性。由于壳聚糖中未反应基团(H3-H6,3.3-4.0ppm)的质子峰与降冰片烯酸酐基团(3.0-3.35ppm)的质子峰重叠,所以H3-H6基团在降冰片烯改性壳聚糖的取代率计算中不能用作内标物,需要另外加入一种内标物,因此加入约5.2mmol/L DMF至溶液中作为内标物,精确称量每一组样品加入DMF的质量,并计算其准确浓度。未改性的壳聚糖和各组降冰片烯改性壳聚糖的化学结构使用1H NMR(Varian 500MHz,USA)在25℃条件分别进行表征。
2.5 动态水分吸附表征(dynamic vapor sorption,DVS)
将取代率为25%~30%之间的降冰片烯改性壳聚糖溶解在水中,配置成2 wt%的水溶液,按照降冰片烯官能团和巯基官能团1∶1的比例,加入交联剂 DTT和1mmol/L光引发剂LAP。LAP 的合成参考Fairbanks等人的研究[25]。溶液避光搅拌均匀后涂布于聚苯乙烯容器中,使用365 nm紫外灯照射充分固化。固化完成后在25℃烘箱中干燥过夜,然后将固化后的降冰片烯改性壳聚糖从容器中剥离。固化后的降冰片烯改性壳聚糖的水吸附/解吸等温线在25℃下使用动态水分吸附仪(DVS Endeavour,Surface Measurement Systems Ltd.,UK)测量。测量前将样品完全干燥,然后相对湿度以10%的阶梯从0%增加到90%,再降低到0%。水吸附和解吸引起的实时样品质量变化使用分辨率为0.1μg的超精密天平系统测量。
3 结果和讨论
3.1 降冰片烯改性壳聚糖的红外光谱分析
壳聚糖和降冰片烯改性壳聚糖的红外光谱如图1所示,降冰片烯改性壳聚糖中二羧酸酐结构中的C=O拉伸振动,表现出1693cm-1处的透射峰;位于2931cm-1处的透射峰源于羰基的C-H拉伸振动[24,26]。此外,在1548cm-1和560-650cm-1范围内,峰值的增加分别归因于酰胺II带(N-H弯曲和C-N拉伸振动)和O=C-N的弯曲运动。
3.2 降冰片烯改性壳聚糖的1H NMR分析
降冰片烯改性壳聚糖的反应机制是降冰片烯基团取代了壳聚糖上脱乙酰化单元中与C-2位置相连的氨基[24]。降冰片烯改性壳聚糖的1H NMR谱图如图2所示。为了测定降冰片烯改性壳聚糖的取代率,需要分别测量和计算每个样品中降冰片烯基团浓度和改性前壳聚糖的初始氨基团的浓度。
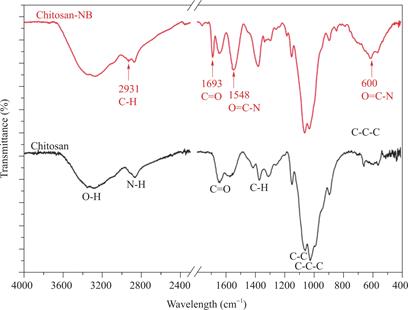
图1 壳聚糖和降冰片烯改性壳聚糖的红外光谱图
Fig.1 FTIR spectra of chitosan and norbornene-functionalized chitosan

图2 降冰片烯改性壳聚糖(DMF内标)的1H NMR谱图
Fig.2 1H NMR spectrum of norbornene-functionalized chitosan(DMF as reference)
3.2.1 降冰片烯改性壳聚糖中降冰片烯基团浓度表征
图2所示的1H NMR谱图显示,5.85-6.4ppm之间的积分峰代表在降冰片烯基团中-C=C-上连接的两个1H的强度[27],7.7-7.9ppm之间的积分峰代表内标物DMF中一个1H的强度[28]。在1H NMR谱图中,峰的积分面积比代表了对应体系中1H的物质的量之比。因此,上述两峰积分面积比即为降冰片烯基团与DMF之间的特定1H的物质的量之比,以此可计算降冰片烯基团与内标物DMF的物质的量之比。继而可以使用以下公式1推导出降冰片烯基团的物质的量。
n(norbornene)=![]() ×n(DMF)×
×n(DMF)×
Integration ratio![]() (1)
(1)
式中:n为物质的量,μmol;Integration ratio 为积分峰面积比。
在配制1H NMR样品时,根据加入的内标物DMF的质量,计算其物质的量,利用1H NMR图谱计算降冰片烯官能团和DMF的特定1H的物质的量之比,并依据公式1计算降冰片烯官能团的物质的量,20组样品结果详见下表2。
表2 改性前后各官能团物质的量汇总
Table 2 Summary of moles for chemical groups in chitosan-NB before and after substitution reactions
|
No. |
n(DMF)/μmol |
Integration ratio(norbornene/DMF) |
n(norbornene)/μmol |
n(-NH2)/μmol |
|
G1 |
5.94 |
1.19 |
3.54 |
25.02 |
|
G2 |
5.84 |
1.93 |
5.63 |
21.60 |
|
G3 |
5.13 |
0.78 |
2.00 |
21.15 |
|
G4 |
4.89 |
1.44 |
3.52 |
21.46 |
|
G5 |
6.40 |
2.13 |
6.82 |
21.70 |
|
G6 |
6.15 |
2.39 |
7.35 |
21.30 |
|
G7 |
6.08 |
2.80 |
8.51 |
20.80 |
|
G8 |
6.27 |
2.01 |
6.31 |
26.95 |
|
G9 |
5.92 |
3.59 |
10.63 |
24.54 |
|
G10 |
5.92 |
3.83 |
11.34 |
26.43 |
|
G11 |
6.12 |
1.20 |
3.67 |
23.60 |
|
G12 |
5.09 |
2.51 |
6.38 |
23.48 |
|
G13 |
5.14 |
0.92 |
2.37 |
18.45 |
|
G14 |
5.18 |
1.38 |
3.57 |
20.70 |
|
G15 |
5.84 |
2.17 |
6.34 |
22.30 |
|
G16 |
6.05 |
1.42 |
4.30 |
21.24 |
|
G17 |
6.19 |
2.64 |
8.17 |
24.65 |
|
G18 |
6.08 |
2.09 |
6.35 |
23.60 |
|
G19 |
6.06 |
2.82 |
8.55 |
27.38 |
|
G20 |
5.90 |
3.21 |
9.46 |
24.68 |
3.2.2 改性前壳聚糖中初始氨基浓度表征
为计算壳聚糖中初始氨基的浓度,需先确定壳聚糖的脱乙酰化度。壳聚糖的脱乙酰化度可以通过不同的方法进行表征,如差示扫描量热仪[29]、红外光谱[30]和核磁共振等 [31-33]。差示扫描量热仪和红外光谱在脱乙酰化度的测定过程中存在局限性,例如差示扫描量热仪的结果可能受到样品制备、基线绘制和热分析条件的影响[29];而使用红外光谱分析脱乙酰化度的结果准确度受到峰的选择的影响[30]。相比之下,核磁共振技术是一种相对快速、精确、稳定的测定壳聚糖脱乙酰化度的方法[31]。
图3显示了未改性的壳聚糖的1H NMR谱图。在1.95ppm附近的积分峰面积代表乙酰基(HAc)上的3个质子的强度,在2.7-4.2ppm处的积分峰面积代表脱乙酰化和乙酰化单体上H2-H6(H26)的6个质子强度,乙酰化和脱乙酰化单体结构如图4所示。
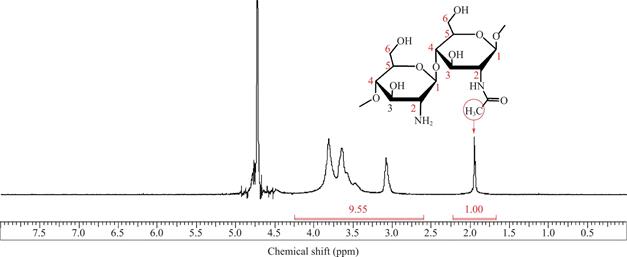
图3 壳聚糖的1H NMR谱图
Fig.3 1H NMR spectrum of chitosan
图4 壳聚糖的乙酰化单体和脱乙酰化单体
Fig.4 The acetylated monomer and deacetylated monomer of chitosan
壳聚糖的脱乙酰化度(DD%)可根据Hirai等研究中提到的公式2计算[33]:
![]() (2)
(2)
式中:DD为脱乙酰化度,%;HAc为乙酰基积分峰面积;H26为H2-H6质子积分峰面积。
根据上述计算,改性前壳聚糖的脱乙酰化度为79.1%。由于壳聚糖的脱乙酰化度约为80%,因此壳聚糖结构的一个重复单元包含四个D-氨基葡萄糖基团(脱乙酰化单体)和一个N-乙酰基-D-氨基葡萄糖基团(乙酰化单体),所以该重复单元的分子量为847g/mol。该壳聚糖结构中每个重复单元中有四个氨基,因此壳聚糖中氨基的量为4.72mmol/g。根据1H NMR 样品制备时,称量的降冰片烯改性壳聚糖的质量,计算壳聚糖中的氨基物质的量如上表2所示。
3.2.3 降冰片烯改性壳聚糖取代程度计算
降冰片烯基团的取代率计算是基于降冰片烯基团和初始氨基团各自物质的量来测定。物质的量之比代表降冰片烯改性壳聚糖的取代率。根据以上计算,降冰片烯改性壳聚糖的取代率计算遵循公式3:
DS%=![]()
=![]() (3)
(3)
式中:DS为取代率,%;n为物质的量,![]() mol;m为质量,g;Integration ratio 为积分峰面积比。
mol;m为质量,g;Integration ratio 为积分峰面积比。
本研究中在不同反应参数条件下得到的20组降冰片烯改性壳聚糖依据公式3计算取代率,结果如表3所示。降冰片烯改性壳聚糖的取代率可以通过调节反应参数在9%至43%之间进行调整。图5显示了取代率从低到高的8个典型1H NMR波谱图,可见在内标物DMF的质子峰强度相同情况下,降冰片烯的质子峰强度逐渐增加。
表3 不同反应参数的20组降冰片烯壳聚糖的取代率汇总
Table 3 DS summary of 20 chitosan groups with different reaction parameters
|
No. |
G1 |
G2 |
G3 |
G4 |
G5 |
G6 |
G7 |
G8 |
G9 |
G10 |
|
DS% |
14% |
26% |
9% |
16% |
31% |
34% |
41% |
23% |
43% |
43% |
|
No. |
G11 |
G12 |
G13 |
G14 |
G15 |
G16 |
G17 |
G18 |
G19 |
G20 |
|
DS% |
16% |
27% |
13% |
17% |
28% |
20% |
33% |
27% |
31% |
38% |
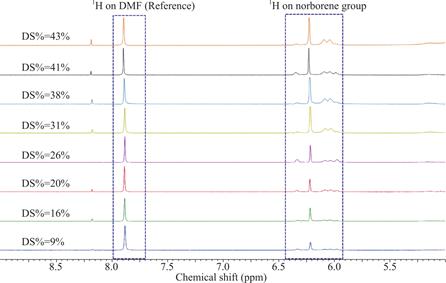
图5 降冰片烯改性壳聚糖的典型1H NMR谱图,取代率在9%至43%之间
Fig.5 1H NMR spectra for chitosan-NB with different DS,ranging from 9% to 43%
3.3 反应条件对取代率的影响
降冰片烯改性壳聚糖的取代反应体系中同时发生两种反应:一是酸酐上的降冰片烯基团取代壳聚糖链上的氨基;另一种是酸酐的水解,它同时影响第一个反应的反应产率。图6显示了这两个反应之间的定性关系的示意图。当反应体系呈酸性时,酸酐与水的反应效率较低,对氨基团的选择性更高。然而,氨基团被质子化,因此取代反应速率也较低。为了提高取代反应速率,一种方法是提高溶液的pH值。同时,酸酐水解速率随pH值的增加而增加[34]。因此,体系中两个反应之间存在动态平衡,对降冰片烯改性壳聚糖取代率的调控可以通过改变反应参数来实现。下面分别分析三个反应参数的变化对取代率的影响。
3.3.1 反应时间对取代率的影响
不同反应时间下取代率与反应物的量(以摩尔比表示)的关系如图7所示。当反应时间为24小时时,反应物过量组(2.5∶1和5∶1)的取代率低于等摩尔量组(1∶1)。其可能的原因是过量的酸酐会降低体系的pH值,壳聚糖上的氨基在酸性环境中被质子化,导致取代反应速率降低,过量反应物反而使得取代反应未在24小时内完成,即酸酐过量组(2.5∶1和5∶1)的取代率低于等摩尔量组。当反应时间增加到48小时和72小时时,取代反应持续进行,因此取代率随着反应物的量的增加而增加。
其中G16组(摩尔比为2.5∶1,反应时间为48小时,无碱处理)为例外。该组的取代率低于G15组(摩尔比为1∶1,反应时间为48小时,无碱处理)。其可能的原因仍然是由于pH值影响反应速率。48小时的反应时间可能仍不足以使取代反应进行完全。另一方面,与其对应的G6组(摩尔比:2.5∶1,反应时间:48小时,碱处理)经过了碱处理,其取代率显著增加。这主要是因为碱处理的作用是通过增加体系的pH值来加速反应速率,因此与G16组相比,可以获得更高的取代率。

图6 降冰片烯改性壳聚糖取代与降冰片烯酸酐水解定性关系示意图
Fig.6 Schematic depicting the qualitative relationship between norbornene-functionalized chitosan substitution and norbornene anhydride hydrolysis

图7 不同反应时间条件下,取代率与摩尔比的关系
Fig.7 The relationships between DS and mole ratio for different reaction times
3.3.2 反应物的量对取代率的影响
不同反应物的量的条件下,取代率与反应时间的关系如图8所示。当反应物的量为等摩尔量时,取代率保持在30%左右,反应时间对取代率无显著影响,表明等摩尔量时的取代能力在30%左右,并且取代反应可在24小时内完成。这一结论可以被酸酐量摩尔比小于1的G1、G11组来佐证。当摩尔比为0.5:1时,取代率被确定为15%左右,是等摩尔量的50%。
反应时间对过量反应物的组别(2.5∶1和5∶1)的取代率有显著影响。如上所述,其可能的原因是过量酸酐导致的酸性环境降低了体系的反应速率,取代反应在24小时甚至48小时内尚未反应完全。因此,取代率随着反应时间的增加而增加。
3.3.3 碱处理对取代率的影响
碱处理过程可以催化酸酐与氨基之间的取代反应;但同时也增加了酸酐的水解速率,进而可能会降低取代反应产率。根据表3所示,与无碱处理组相比,碱处理组具有更高的取代率。但是,如果取代反应在碱处理前完成,则碱处理不会显著影响取代率,例如摩尔比小于等于1的四组。总体来说,碱处理对于取代反应的催化贡献更大,并没有因酸酐水解而产生负收益。
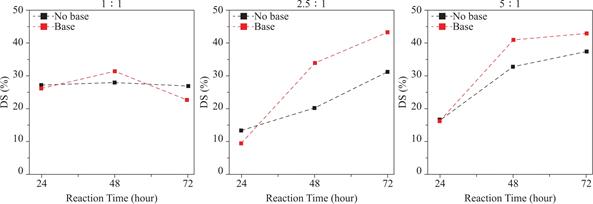
图8 不同摩尔比条件下,取代率与反应时间的关系
Fig.8 The relationships between DS and reaction time with different mole ratios
3.4 降冰片烯改性壳聚糖的动态水分吸附测试
固化后的降冰片烯改性壳聚糖的水蒸气等温线如图9所示。当相对湿度从0~90%增加时,降冰片烯改性壳聚糖的质量变化为52%。当湿度下降时,质量随之下降。吸附等温线的吸附解吸曲线之间的出现的少量滞后可能是由于壳聚糖-水分相互作用、壳聚糖孔隙率和毛细管凝结等原因[35,36]。
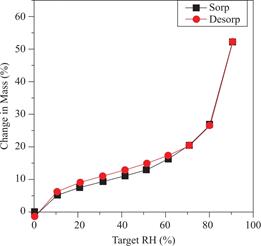
图9 动态水吸收仪检测降冰片烯改性壳聚糖水凝胶随相对湿度变化而产生的质量变化
Fig.9 Changes in mass of norbornene-functionalized chitosan respond to change in relative humidity(%P/P0) followed using dynamic vapor sorption
4 结论
本研究通过调节取代反应参数,制备了一系列不同取代率的降冰片烯改性壳聚糖,并使用1H NMR来表征计算其取代率,其范围在9%~43%。改性后的壳聚糖材料可溶于水,并可发生光固化交联,形成水凝胶结构,其结构可吸水膨胀,失水收缩而不发生溶解和结构破坏。其优异的吸水性能结合其特有的抗菌、抗炎等特性,使改性壳聚糖材料在药物递送、医用敷料等领域具有更为广阔的应用前景。在对研究中的取代反应进行分析时发现,反应物的量、反应时间以及体系的酸碱度对最终产物的取代率有显著影响;同时由于反应体系中取代反应和酸酐水解反应同时发生,相互影响,因此不同反应参数之间存在强关联。本研究详细阐述了该类取代反应的反应机理,为后续降冰片烯改性水凝胶研究提供理论依据,继而可以通过设计、控制反应参数来调节改性反应的取代率。对于取代度的定量计算为生物医用领域设计光固化水凝胶结构以及后续制造过程提供了选择最佳参数的方法。
利益冲突: 作者声明没有利益冲突。
[①] 通讯作者 Corresponding author:吕诗达,shidalyu@outlook.com
收稿日期:2024-09-01; 录用日期:2024-09-24; 发表日期:2024-12-28
参考文献(References)
[1] 王双燕. 壳聚糖及其衍生物在医药领域的研究进展[J]. 云南化工, 2021, 48(04): 7-8+16. 10. 3969/j. issn. 1672-2981. 2007. 03. 022
[2] 齐远征, 焦俊杰, 李永丽, 等. 壳聚糖促进口腔软组织修复的研究进展[J]. 现代口腔医学杂志, 2021, 35(6).
[3] 刘卓冉, 李玉梅, 刘俊彦, 等. 口腔抗菌领域中壳聚糖及其衍生物的作用[J]. 中国组织工程研究, 2023, 27(21): 3361-3367.
[4] 邹俊东, 刘定坤, 杨楠, 等. 生物活性玻璃/壳聚糖复合材料在生物医学领域的应用[J]. 国际口腔医学杂志, 2020, 47(01): 90-94.
https://doi.org/10.7518/gjkq.2020002
[5] 邱赛男, 臧睿觉, 梅予峰, 等. 氟化钠壳聚糖凝胶对乳牙釉质抗酸能力的影响[J]. 口腔医学, 2022, 42(01): 68-71+91.
https://doi.org/10.13591/j.cnki.kqyx.2022.01.012.
[6] 库得来提·阿不都克力木, 董红宾, 多力昆·吾甫尔.壳聚糖温敏水凝胶在口腔相关组织工程的应用进展[J]. 口腔医学, 2024, 44(02): 139-143.
https://doi.org/10.13591/j.cnki.kqyx.2024.02.011.
[7] 田宇航, 刘亚东, 崔宇韬, 等. 壳聚糖生物材料支架在治疗感染性骨缺损中的应用[J]. 中国组织工程研究, 2022, 26(21): 3415-3420.
[8] 汤薇, 董静, 赵金荣, 等. 壳聚糖改性及改性壳聚糖应用研究进展[J]. 济南大学学报(自然科学版), 2023, 37(01): 84-93.
https://doi.org/10.13349/j.cnki.jdxbn.20220928.002.
[9] LYU S, ZHENG F, AGUILAR-TADEO J A, et al. Patterned, morphing composites via maskless photo-click lithography[ J/OL]. Soft Matter, 2020, 16(5): 1270-1278.
https://doi.org/10.1039/C9SM02056J.
[10] REDAELLI F, SORBONA M, ROSSI F. Synthesis and processing of hydrogels for medical applications[M/ OL]//Bioresorbable Polymers for Biomedical Applications: From Fundamentals to Translational Medicine. Elsevier Ltd, 2016.
http://dx.doi.org/10.1016/B978-0-08-100262-9.00010-0.
[11] 王喆麟, 黄彩娟. 通过巯基-烯点击反应快速合成生物基热固性树脂的研究进展[J]. 塑料工业, 2023, 51(06): 24-29.
https://doi.org/10.3969/j.issn.1005-5770.2023.06.004
[12] KHIRE V S, KLOXIN A M, COUCH C L, et al. Synthesis, characterization and cleavage of linear polymers attached to silica nanoparticles formed using thiol-acrylateconjugate addition reactions[J/OL]. Journal ofPolymer Science Part A: Polymer Chemistry, 2008, 46(20): 6896-6906.
http://doi.wiley.com/10.1002/pola.22999.
[13] MUNOZ Z, SHIH H, LIN C C. Gelatin hydrogelsformed by orthogonal thiol-norbornene photochemistryfor cell encapsulation[J/OL]. Biomater. Sci. , 2014, 2(8): 1063-1072.
http://xlink.rsc.org/?DOI=C4BM00070F.
[14] LIAO H, MUNOZ-PINTO D, QU X, et al. Influence ofhydrogel mechanical properties and mesh size on vocalfold fibroblast extracellular matrix production and phenotype[J/OL]. Acta Biomaterialia, 2008, 4(5): 1161-1171.
http://linkinghub.elsevier.com/retrieve/pii/S1742706108001074.
[15] FAIRBANKS B D, SCHWARTZ M P, HALEVI A E, et al. A Versatile Synthetic Extracellular Matrix Mimicvia Thiol-Norbornene Photopolymerization[J/OL]. AdvancedMaterials, 2009, 21(48): 5005-5010.
http://doi.wiley.com/10.1002/adma.200901808.
[16] HOYLE C E, LEE T Y, ROPER T. Thiol-enes: Chemistryof the past with promise for the future[J/OL]. Journal of Polymer Science Part A: Polymer Chemistry, 2004, 42(21): 5301-5338.
http://doi.wiley.com/10.1002/pola.20366.
[17] 郑淑娟, 仝涛, 许文涛, 等. 巯基-烯点击反应介导的生物传感研究进展[J]. 生物技术通报, 2021, 37(12): 243-251.
https://doi.org/10.13560/j.cnki.biotech.bull.1985.2021-0329.
[18] WALKER C N, SARAPAS J M, KUNG V, et al. Multiblock Copolymers by Thiol Addition Across Norbornene[J/OL]. ACS Macro Letters, 2014, 3(5): 453-457.
http://pubs.acs.org/doi/10.1021/mz5001288.
[19] LIN C C, KI C S, SHIH H. Thiol-norbornene photoclickhydrogels for tissue engineering applications[J/OL]. Journal of Applied Polymer Science, 2015, 132(8): 41563.
http://doi.wiley.com/10.1002/app.41563.
[20] PEREIRA R F, BARRIAS C C, BÁRTOLO P J, et al. Cell-instructive pectin hydrogels crosslinked via thiolnorbornenephoto-click chemistry for skin tissue engineering[J/OL]. Acta Biomaterialia, 2018, 66: 282-293.
https://doi.org/10.1016/j.actbio.2017.11.016.
[21] BLANK F, JANIAK C. Metal catalysts for the vinyl/addition polymerization of norbornene[J/OL]. CoordinationChemistry Reviews, 2009, 253(7-8): 827-861.
https://doi.org/10.1016/j.ccr.2008.05.010.
[22] PERERA M M, AYRES N. Gelatin based dynamic hydrogelsvia thiol-norbornene reactions[J/OL]. PolymerChemistry, 2017, 8(44): 6741-6749.
https://doi.org/10.1039/C7PY01630A.
[23] HOYLE C E, BOWMAN C N. Thiol-Ene Click Chemistry[J/OL]. Angewandte Chemie International Edition, 2010, 49(9): 1540-1573.
https://doi.org/10.1002/anie.200903924.
[24] MARSILLA K, ISHAK K, AHMAD Z, et al. Synthesisand characterization of cis-5-norbornene-2, 3-dicarboxylicanhydride-chitosan[J]. e-polymers, 2010(064): 1-11.
[25] FAIRBANKS B D, SCHWARTZ M P, BOWMAN CN, et al. Photoinitiated polymerization of PEG-diacrylatewith lithium phenyl-2, 4, 6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility[J/OL]. Biomaterials, 2009, 30(35): 6702-6707.
https://doi.org/10.1016/j.biomaterials.2009.08.055.
[26] SOCRATES G. Infrared Characteristic Group Frequencies: Tables and Charts[M]. Second Edi. John Wiley &Sons, 1994.
[27] TRUONG V X, HUN M L, LI F, et al. In situ-formingclick-crosslinked gelatin based hydrogels for 3D cultureof thymic epithelial cells[J/OL]. Biomaterials Science, 2016, 4(7): 1123-1131.
https://doi.org/10.1039/C6BM00254D.
[28] FULMER G R, MILLER A J M, SHERDEN N H, etal. NMR Chemical Shifts of Trace Impurities: CommonLaboratory Solvents, Organics, and Gases in DeuteratedSolvents Relevant to the Organometallic Chemist[J/OL]. Organometallics, 2010, 29(9): 2176-2179.
https://doi.org/10.1021/om100106e.
[29] GUINESI L S, CAVALHEIRO É T G. The use of DSCcurves to determine the acetylation degree of chitin/chitosansamples[J/OL]. Thermochimica Acta, 2006, 444(2): 128-133.
https://doi.org/10.1016/j.tca.2006.03.003.
[30] BAXTER A, DILLON M, ANTHONY TAYLOR KD, et al. Improved method for i. r. determination of thedegree of N-acetylation of chitosan[J/OL]. InternationalJournal of Biological Macromolecules, 1992, 14(3): 166-169.
https://doi.org/10.1016/S0141-8130(05)80007-8.
[31] LAVERTU M, XIA Z, SERREQI A N, et al. A validated1H NMR method for the determination of the degreeof deacetylation of chitosan[J/OL]. Journal ofPharmaceutical and Biomedical Analysis, 2003, 32(6): 1149-1158.
https://doi.org/10.1016/S0731-7085(03)00155-9.
[32] VÅRUM K M, ANTOHONSEN M W, GRASDALENH, et al. Determination of the degree of N-acetylationand the distribution of N-acetyl groups in partially Ndeacetylatedchitins(chitosans)by high-field n. m. r. spectroscopy[J/OL]. Carbohydrate Research, 1991, 211(1): 17-23.
https://doi.org/10.1016/0008-6215(91)84142-2.
[33] HIRAI A, ODANI H, NAKAJIMA A. Determinationof degree of deacetylation of chitosan by 1H NMRspectroscopy[J/OL]. Polymer Bulletin, 1991, 26(1): 87-94.
https://doi.org/10.1007/BF00299352.
[34] CLAYDEN J, GREEVES N, WARREN, et al. OrganicChemistry[M]. Second. Oxford University Press, 2012.
[35] DRIEMEIER C, MENDES F M, OLIVEIRA M M. Dynamicvapor sorption and thermoporometry to probewater in celluloses[J/OL]. Cellulose, 2012, 19(4): 1051-1063.
https://doi.org/10.1007/s10570-012-9727-z.
[36] HASSEL R L, PH D, HESSE N D, et al. Characterizationof Water Adsorption and Absorption in Pharmaceuticals: Vol. 1[R].
Research of Norbornene Functionalized Chitosan with Tailorable Degree of Substitution
(Shanghai EA Medical Instrument Co. , Ltd. , Shanghai 200433, China)
Abstract: Chitosan has attracted widespread attention in the medical industry because of its abundant yield, biocompatibility, biodegradability, antibacterial and anti-inflammatory properties. However, chitosan shows limited water solubility, preventing its development. To functionalize chitosan to water-soluble chitosanbased hydrogels, such as photo-curable hydrogels, which can be widely used in cell culture, tissue engineering, 3D printing and other fields. In the field of photocuring reactions, the thiol-norbornene click reaction is worth to be studied due to its extremely high reactivity. In this research, a family of norbornene-functionalized chitosan were prepared by changing the reaction parameters, including the amount of reactants, reaction time and pH of the system. A calculation method of degree of substitution was proposed, based on the characterization of 1H nuclear magnetic resonance spectroscopy. The research investigated that in this chitosan functionalized reaction system, the substitution reaction and the anhydride hydrolysis reaction occur simultaneously and intact, and and the two reactions affect each other The reaction rate and degree of substitution can be tailored by comprehensively adjusting the reaction parameters. The degree of substitution ranged from 9% to 43% in this research. Norbornene-functionalized chitosan was able to absorb water more than 50% in mass change, and its excellent water absorption ability can be used in the application areas of wound healing and drug delivery and other fields.
Keywords: Chitosan, Norbornene, Thiol-ene Click Reaction, 1H NMR
DOI: 10.48014/pcms.20240901001
Citation: LYU Shida. Research of norbornene functionalized chitosan with tailorable degree of substitution[J]. Progress in Chinese Materials Sciences, 2024, 3(4): 42-53.